West Nile Virus: vent’anni dopo, una sfida multifattoriale
Tra il 2010 e il 2024, in 25 paesi europei, tra cui l’Italia (1), è stato segnalato almeno un caso autoctono umano di Febbre del Nilo Occidentale. Il progressivo aumento dei casi confermati, sia nell’uomo sia negli animali, ha reso questa infezione un problema emergente di sanità pubblica evidenziando la necessità di una sorveglianza continua e di misure di prevenzione mirate.
Il West Nile Virus (WNV), è un’agente patogeno ad RNA, neurotropo e zoonotico, appartenente al genere Flavivirus, famiglia Flaviviridae, il cui ciclo di trasmissione coinvolge principalmente uccelli e zanzare ornitofile e occasionalmente uomo ed equidi, i quali sono considerati ospiti accidentali a fondo cieco. Gli ospiti accidentali non sviluppano una viremia di intensità tale da consentire l'infezione di un nuovo vettore e quindi non sono in grado di garantire il mantenimento del ciclo di trasmissione (2).
Numerose sono le specie aviarie che possono essere infettate dal WNV, ma corvidi e rapaci sembrano essere le più suscettibili (3). Mentre per quanto riguarda i vettori, nel contesto europeo quelli maggiormente rilevati nell'ambito dei focolai appartengono al genere Culex, sebbene il virus possa essere trasmesso anche da zanzare appartenenti ad altri generi e specie (4).
Le zanzare appartenenti al genere Culex colonizzano le pozze d’acqua come pozzanghere, canali di irrigazione, raccolta dell’acqua piovana lungo le strade, abbeveratoi e fontane, e sono particolarmente attive al crepuscolo. L’uomo generalmente contrae l’infezione attraverso le punture di queste zanzare, ma è possibile anche una trasmissione diretta attraverso le trasfusioni di sangue e il trapianto di organi e tessuti contaminati (5).
Diversi lineages sono stati identificati in tutto il mondo, ma i ceppi responsabili di gravi epidemie sono attribuibili al Lineage 1 e al Lineage 2. Le analisi filogenetiche hanno rivelato che i ceppi circolanti in Europa appartenenti ai Lineage 1 e 2 provengono da un numero limitato di introduzioni indipendenti, molto probabilmente dall'Africa, seguite da diffusione ed endemizzazione locale (6).
Nell’uomo la maggior parte delle infezioni decorre in forma asintomatica (80%), mentre nel 20% dei casi si può manifestare una sintomatologia simil-influenzale caratterizzata da febbre, cefalea, mialgie e astenia. In meno dell’1% dei casi, il virus può causare forme neuro-invasive gravi (West Nile Neuroinvasive Disease - WNND), con complicanze come encefalite, meningite e paralisi flaccida acuta, principalmente nei soggetti anziani e immunocompromessi. Ad oggi, non esistono vaccini né trattamenti specifici per l’uomo (7).
Per quanto riguarda gli equidi solo il 20% può sviluppare forme cliniche febbrili e neurologiche, le quali possono portare a morte con una probabilità che può arrivare al 50% nei cavalli non vaccinati. L'intensità dei sintomi è stata spesso associata a specifici genotipi del virus, sebbene tale correlazione non risulti sempre univoca (8).
Diffusione geografica ed evoluzione
Tra le malattie trasmesse da vettori, la WND è una delle più diffuse a livello globale. Il virus West Nile (WNV) è stato isolato per la prima volta nel 1937 in Uganda, in una donna con febbre. Oggi è presente in Asia, Europa, Australia e America.
A partire dal 1958, la circolazione virale ha interessato l’Europa e il bacino del Mediterraneo, con casi segnalati in Francia, Portogallo e Cipro. Nel 1999, il virus è stato identificato per la prima volta nel Nuovo Continente, causando una grave epidemia a New York, che ha coinvolto uccelli selvatici e da zoo, cavalli e esseri umani (9). La sua espansione è proseguita nei decenni successivi, coinvolgendo Bulgaria e Grecia (2010), Albania e Macedonia (2011), Croazia, Serbia e Kosovo (2012) (10). Nel 2018, i primi casi autoctoni sono stati rilevati in alcuni esemplari di uccelli in Germania (11), seguiti dai primi casi umani nei Paesi Bassi nel 2020 (12).
Fino al 2004, in Europa erano presenti esclusivamente ceppi appartenenti al Lineage 1, responsabile di infezioni sporadiche (13). Mentre il Lineage 2 inizialmente confinato all’Africa subsahariana, è emerso in Europa dai primi anni 2000, causando gravi forme neuro-invasive nell’uomo e nel cavallo (14).
Ad oggi la West Nile Disease (WND) in Europa è considerata una malattia endemica a carattere epidemico, con cicli di trasmissione annuali.
West Nile Virus in Italia: diffusione ed evoluzione epidemiologica
In Italia, il virus WN è stato segnalato per la prima volta nel 1998 in Toscana, in occasione di un'epidemia causata dal lineage 1, che ha provocato gravi sintomi clinici nei cavalli (15).
A seguito di questo primo focolaio, nel 2001, il Ministero della Salute ha emanato il piano nazionale di sorveglianza veterinaria. Tuttavia, fino al 2008 non sono stati rilevati nuovi casi. In quell’anno, la circolazione virale è stata confermata nell’area del delta del Po, con positività riscontrate in zanzare, uccelli, cavalli e anche nell’uomo. Da allora il virus ha continuato a circolare diventando endemico in diverse regioni del Paese, con focolai stagionali ricorrenti (16, 17).
Nel corso degli anni, il sistema di sorveglianza è stato progressivamente aggiornato, in risposta all’evoluzione dello scenario epidemiologico, al fine di individuare precocemente la circolazione virale e attivare tempestivamente le misure di controllo per prevenire il rischio di trasmissione all’uomo. A partire dal 2008 l'Italia ha registrato una circolazione sostenuta del virus, con un aumento del numero di casi notificati ogni anno. Ad oggi, epidemie di WNV sono state rilevate annualmente, sostenute da ceppi geneticamente differenti e focolai sono stati segnalati in 18 regioni italiane (Figura 1a, 1b).
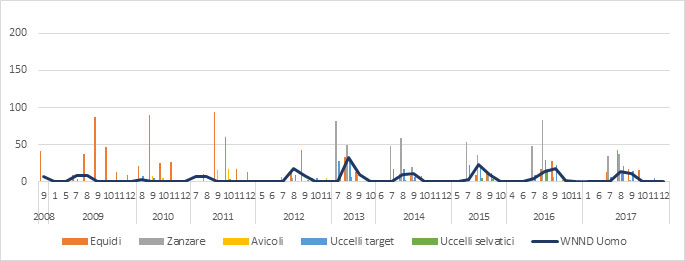
Figura 1a.Circolazione del virus della West Nile Fever dal 2008 al 2017 in Italia. Ogni barra rappresenta il numero di positività rilevate in ogni specie oggetto di sorveglianza, suddivise per mese. Al dato veterinario è associato il numero di casi umani di WNND notificati nello stesso periodo. (fonte dati: Sistema Informativo Malattie Animali-SIMAN).
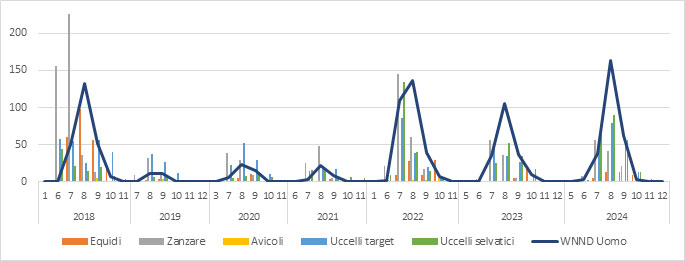
Figura 1b.Circolazione del virus della West Nile Fever dal 2018 al 2024 in Italia. Ogni barra rappresenta il numero di positività rilevate in ogni specie oggetto di sorveglianza, suddivise per mese. Al dato veterinario è associato il numero di casi umani di WNND notificati nello stesso periodo. (fonte dati SIMAN).
Circolazione del virus West Nile nella stagione epidemica 2024

Figura 2.Distribuzione geografica dei Lineage 1 e 2, del virus della West Nile nel 2024 (fonte dati SIMAN).
Nel corso della stagione epidemica 2024, le attività di sorveglianza hanno confermato, per la prima volta, la presenza del virus West Nile in Abruzzo. Il 17 giugno, è stata rilevata una positività in un pool di zanzare catturate in provincia di Chieti rappresentando la prima evidenza di circolazione virale nella regione dall’avvio del sistema di sorveglianza. Nella stessa settimana, il virus è stato identificato anche in Veneto, in provincia di Padova. Nei mesi successivi, focolai sono stati confermati nelle aree endemiche del Nord Italia, tra cui Emilia-Romagna, Lombardia, Friuli Venezia Giulia, Piemonte e Veneto. Ulteriori positività sono state riscontrate anche in regioni del Centro-Sud, tra cui Puglia, Campania e nuovamente Abruzzo. Nel mese di agosto, il virus è stato individuato anche in Toscana e Sardegna, mentre, al termine della stagione epidemica, sono stati segnalati per la prima volta casi nella regione Molise (Figura 2).
Secondo le fonti ufficiali (SIMAN e ISS), le positività al virus West Nile riscontrate in Italia nel 2024 sono state le seguenti:
- 66 pool di zanzare
- 228 uccelli selvatici
- 203 uccelli appartenenti a specie bersaglio (Gazza, Cornacchia, Ghiandaia)
46 cavalli con sintomi clinici (38 focolai) (fonte SIMAN) - 460 casi umani confermati, di cui 272 con forma neuro-invasiva
(fonte Istituto Superiore di Sanità-ISS)
Le mappe di seguito (Figure 3a, 3b, 3c) illustrano l'espansione geografica della circolazione del virus (aree colpite evidenziate in verde).
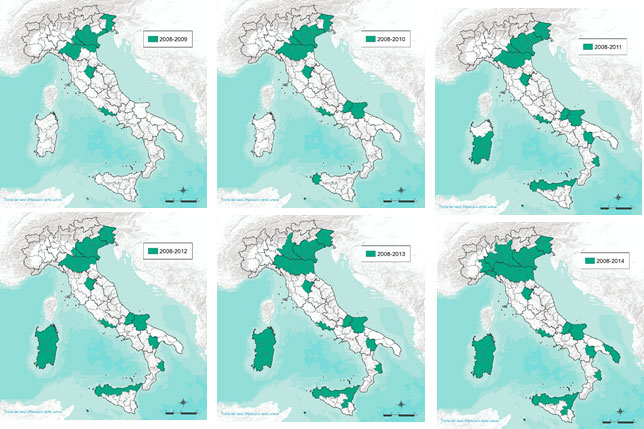
Figura 3a.Diffusione del virus della West Nile in Italia (Anni 2008-2014).

Figura 3b.Diffusione del virus della West Nile in Italia (Anni 2015-2020).
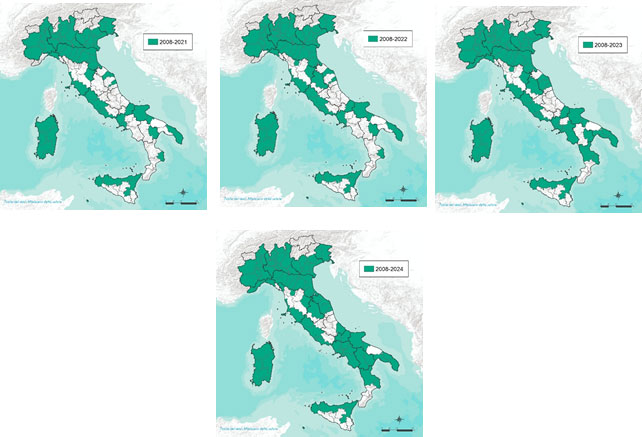
Figura 3c.Diffusione del virus della West Nile in Italia (Anni 2021-2024).
A partire dal 2021 la diffusione della malattia si è mantenuta pressoché stabile rispetto all’anno precedente. Nel 2022, però, sono comparsi nuovi focolai in Toscana e in Umbria, segnando una prima estensione geografica. Nel 2023 la circolazione virale si è ampliata, interessando quasi tutta la regione Marche (con l’eccezione della provincia di Pesaro), gran parte della Campania e alcune aree della Calabria. Nel 2024 l’espansione è proseguita, con il coinvolgimento dell’intera Campania, della totalità delle Marche, del Molise e della Basilicata, di una provincia dell’Abruzzo e di gran parte della Puglia.
Un problema multifattoriale: il ruolo del clima e delle attività umane
L'epidemiologia e il ciclo di trasmissione del virus del Nilo occidentale sono molto complessi e strettamente correlati a fattori abiotici e biotici (18).
La comparsa e la diffusione annuale della West Nile Disease sono fortemente influenzate da fattori abiotici come temperatura, precipitazioni e condizioni ambientali, strettamente legati anche alle modalità di utilizzo del suolo. Accanto a questi, giocano un ruolo determinante i fattori biotici: l’abbondanza e la diversità degli ospiti, la distribuzione dei vettori e le rotte migratorie degli uccelli, che favoriscono la circolazione del virus. Negli ultimi anni, i cambiamenti climatici e il progressivo riscaldamento globale hanno accentuato tali dinamiche, facilitando la diffusione del WNV nei Paesi europei a clima temperato – Italia inclusa (19) – dove il decennio recente è stato caratterizzato da ricorrenti anomalie climatiche, con temperature stabilmente al di sopra della media e significative alterazioni nei regimi delle precipitazioni (20, 21).
In aggiunta, gioca un ruolo importante nella distribuzione del virus anche il posizionamento dell'Italia lungo le rotte migratorie che collegano le aree di svernamento africane con quelle di riproduzione in Europa. Il Paese è pertanto costantemente esposto al rischio di introduzione di nuovi ceppi virali. L’incidenza della malattia potrebbe quindi essere anche dai cambiamenti nel comportamento degli uccelli migratori, a loro volta legati da variazioni climatiche (22).
Conclusioni e Prospettive: un futuro da monitorare
Il West Nile Virus si è ormai affermato come patogeno endemo-epidemico in Italia, la cui diffusione rispecchia le tendenze climatiche e ambientali in continua evoluzione. A vent’anni dalla prima comparsa, il WND rappresenta oggi una sfida per la sanità pubblica e veterinaria del Paese. La crescente diffusione geografica e l’impatto sulle fasce più vulnerabili della popolazione, evidenziano la costante necessità di aggiornare i sistemi di sorveglianza e prevenzione.
Nel complesso scenario delle malattie trasmesse da vettori, l’Italia ha sviluppato una strategia che integrata che unisce sorveglianza veterinaria, umana ed entomologica, con l’obiettivo di rilevare precocemente la circolazione virale in una nuova area e di attivare tempestivamente le misure necessarie per limitare la trasmissione dell’infezione all’uomo. Tali misure includono il controllo sulle trasfusioni e trapianti e sui trapianti, nonché interventi diretti sui vettori.
Le attività di sorveglianza, in ambito umano e veterinario, sono coordinate dal Ministero della Salute e supportate rispettivamente dal Dipartimento Malattie Infettive dell’Istituto Superiore di Sanità e dal Centro di Referenza Nazionale per lo studio e l’accertamento delle malattie esotiche (CESME) (Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise) a cui afferiscono le attività di conferma diagnostica esaminate dai rispettivi IIZZSS distribuiti sul territorio.
È altresì importante promuovere comportamenti individuali di protezione, specialmente nei mesi più caldi: l’uso di repellenti contro le zanzare, la rimozione di raccolte d’acqua stagnante e la protezione degli ambienti domestici con zanzariere. A livello ambientale, molte province italiane adottano interventi stagionali di controllo delle popolazioni di zanzare, attraverso campagne di sensibilizzazione, ordinanze comunali, trattamenti larvicidi nei tombini e bonifiche nelle aree a rischio. Queste azioni preventive, semplici ma fondamentali, giocano un ruolo cruciale nel ridurre la trasmissione del virus e nel tutelare la salute pubblica.
L’esperienza italiana dimostra come la presenza stabile del WNV richieda una strategia di risposta dinamica e multilivello, basata sulla collaborazione continua tra sanità pubblica, medicina veterinaria e gestione ambientale. In un contesto climatico ed ecologico in rapida evoluzione, è indispensabile mantenere alta l’attenzione verso i virus trasmessi da vettori aggiornando costantemente le conoscenze scientifiche e le politiche sanitarie.
Ringraziamenti
Si ringraziano Federica Iapaolo (CESME) per il contributo alla stesura dell’articolo, e Francesca Dall’Acqua e Valentina Zenobio (COVEPI) per il lavoro di revisione scientifica e strutturazione dei dati, che hanno assicurato coerenza metodologica e accuratezza scientifica all’articolo.
Referenze
- ECDC https://www.ecdc.europa.eu/en/west-nile-fever/surveillance-and-disease-data/historical
- Habarugira, G.; Suen, W.W.; Hobson-Peters, J.; Hall, R.A.; Bielefeldt-Ohmann, H. West Nile Virus: An Update on Pathobiology, Epidemiology, Diagnostics, Control and “One Health” Implications. Pathogens 2020, 9, 589.
- Vidaña, B.; Busquets, N.; Napp, S.; Pérez-Ramírez, E.; Jiménez-Clavero, M.Á.; Johnson, N. The Role of Birds of Prey in West Nile Virus Epidemiology. Vaccines 2020, 8, 550. https://doi.org/10.3390/vaccines80305503. Popescu, C.P.; Florescu, S.A.; Ruta, S.M. West Nile Virus in Central Europe—Pandora’s Box Is Wide Open! Travel Med. Infect. Dis. 2020, 37, 101864.
- Vogels CB, Göertz GP, Pijlman GP, Koenraadt CJ. Vector competence of European mosquitoes for West Nile virus. Emerg Microbes Infect. 2017 Nov 8;6(11):e96. doi: 10.1038/emi.2017.82. PMID: 29116220; PMCID: PMC5717085.
- Colpitts TM, Conway MJ, Montgomery RR, Fikrig E. West Nile Virus: biology, transmission, and human infection. Clin Microbiol Rev. 2012 Oct;25(4):635-48. doi: 10.1128/CMR.00045-12. PMID: 23034323; PMCID: PMC3485754.
- Bakonyi T, Ivanics E, Erdélyi K, Ursu K, Ferenczi E, Weissenböck H, Nowotny N. Lineage 1 and 2 strains of encephalitic West Nile virus, central Europe. Emerg Infect Dis. 2006 Apr;12(4):618-23. doi: 10.3201/eid1204.051379. PMID: 16704810; PMCID: PMC3294705.
- Byas AD, Ebel GD. Comparative Pathology of West Nile Virus in Humans and Non-Human Animals. Pathogens. 2020 Jan 7;9(1):48. doi: 10.3390/pathogens9010048. PMID: 31935992; PMCID: PMC7168622.
- Angenvoort J, Brault AC, Bowen RA, Groschup MH. West Nile viral infection of equids. Vet Microbiol. 2013 Nov 29;167(1-2):168-80. doi: 10.1016/j.vetmic.2013.08.013. Epub 2013 Aug 28. PMID: 24035480; PMCID: PMC4581842.
- Nash, D., Mostashari, F., Fine, A., Miller, J., O'Leary, D., Murray, K., Huang, A., Rosenberg, A., Greenberg, A., Sherman, M., Wong, S., Layton, M., & 1999 West Nile Outbreak Response Working Group (2001). The outbreak of West Nile virus infection in the New York City area in 1999. The New England journal of medicine, 344(24), 1807–1814. https://doi.org/10.1056/NEJM200106143442401
- Koch RT, Erazo D, Folly AJ, et al. Genomic epidemiology of West Nile virus in Europe. One Health. 2023;18:100664. Published 2023 Dec 16. doi:10.1016/j.onehlt.2023.100664
- Nash, D., Mostashari, F., Fine, A., Miller, J., O'Leary, D., Murray, K., Huang, A., Rosenberg, A., Greenberg, A., Sherman, M., Wong, S., Layton, M., & 1999 West Nile Outbreak Response Working Group (2001). The outbreak of West Nile virus infection in the New York City area in 1999. The New England journal of medicine, 344(24), 1807–1814. https://doi.org/10.1056/NEJM200106143442401
- Ziegler, U., Lühken, R., Keller, M., Cadar, D., van der Grinten, E., Michel, F., Albrecht, K., Eiden, M., Rinder, M., Lachmann, L., Höper, D., Vina-Rodriguez, A., Gaede, W., Pohl, A., Schmidt-Chanasit, J., & Groschup, M. H. (2019). West Nile virus epizootic in Germany, 2018. Antiviral research, 162, 39–43. https://doi.org/10.1016/j.antiviral.2018.12.005
- Vlaskamp, D. R., Thijsen, S. F., Reimerink, J., Hilkens, P., Bouvy, W. H., Bantjes, S. E., Vlaminckx, B. J., Zaaijer, H., van den Kerkhof, H. H., Raven, S. F., & Reusken, C. B. (2020). First autochthonous human West Nile virus infections in the Netherlands, July to August 2020. Euro surveillance: bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin, 25(46), 2001904. https://doi.org/10.2807/1560-7917.ES.2020.25.46.2001904
- Silverj A, Mencattelli G, Monaco F, et al. Origin and evolution of West Nile virus lineage 1 in Italy. Epidemiol Infect. 2024;152:e150. Published 2024 Dec 2. doi:10.1017/S0950268824001420
- Mencattelli G, Silverj A, Iapaolo F, et al. Epidemiological and Evolutionary Analysis of West Nile Virus Lineage 2 in Italy. Viruses. 2022;15(1):35. Published 2022 Dec 22. doi:10.3390/v15010035
- Autorino GL, Battisti A, Deubel V, Ferrari G, Forletta R, Giovannini A, Lelli R, Murri S, Scicluna MT. West Nile virus epidemic in horses, Tuscany region, Italy. Emerg Infect Dis. 2002 Dec;8(12):1372-8. doi: 10.3201/eid0812.020234. PMID: 12498650; PMCID: PMC2738505.
- Rizzo C, Salcuni P, Nicoletti L, Ciufolini MG, Russo F, Masala R, et al. Epidemiological surveillance of West Nile neuroinvasive diseases in Italy, 2008 to 2011. Euro Surveill. 2012;17(20):20172.
- Marcantonio M, Rizzoli A, Metz M, et al. Identifying the environmental conditions favouring West Nile Virus outbreaks in Europe. PLoS One. 2015;10(3):e0121158. Published 2015 Mar 24. doi:10.1371/journal.pone.0121158
- Magurano F, Remoli ME, Baggieri M, Fortuna C, Marchi A, Fiorentini C, et al. Circulation of West Nile virus lineage 1 and 2 during an outbreak in Italy. Clin Microbiol Infect. 2012;18(12):E545-7. 10.1111/1469-0691.12018
- Paz S, Semenza JC. Environmental drivers of West Nile fever epidemiology in Europe and Western Asia--a review. Int J Environ Res Public Health. 2013 Aug 9;10(8):3543-62. doi: 10.3390/ijerph10083543. PMID: 23939389; PMCID: PMC3774453.
- Riccardo F, Bella A, Monaco F, Ferraro F, Petrone D, Mateo-Urdiales A, Andrianou XD, Del Manso M, Venturi G, Fortuna C, Di Luca M, Severini F, Caporali MG, Morelli D, Iapaolo F, Pati I, Lombardini L, Bakonyi T, Alexandra O, Pezzotti P, Perrotta MG, Maraglino F, Rezza G, Palamara AT; Italian Arbovirus Surveillance network. Rapid increase in neuroinvasive West Nile virus infections in humans, Italy, July 2022. Euro Surveill. 2022 Sep;27(36):2200653. doi: 10.2807/1560-7917.ES.2022.27.36.2200653. PMID: 36082685; PMCID: PMC9461310.
- Lelli R, Calistri P, Bruno R, Monaco F, Savini G, Di Sabatino D, Corsi I, Pascucci I. West Nile transmission in resident birds in Italy. Transbound Emerg Dis. 2012 Oct;59(5):421-8. doi: 10.1111/j.1865-1682.2011.01287.x. Epub 2011 Dec 28. PMID: 22212727.
Autori (istituzionali)
- Centro Operativo Veterinario per l’Epidemiologia, Programmazione, Informazione e Analisi del Rischio (COVEPI), Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise “G. Caporale”
- Centro di Referenza Nazionale per le Malattie Esotiche degli Animali (CESME), Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise “G. Caporale”