Dal pollame agli uccelli selvatici e ai mammiferi: l’evoluzione genetica del virus dell’influenza aviaria HPAI H5N1 e il timore per una futura trasmissione interumana
Identificati per la prima volta in Cina nel 1996, i virus dell’influenza aviaria ad alta patogenecità HPAI A (H5Nx) appartenenti al lineage A/Goose/Guangdong/1/1996 (Gs/Gd) si sono rapidamente evoluti in una delle principali minacce sanitarie globali. I virus H5Nx, a partire dai primi anni 2000, hanno causato gravi e numerose epidemie avicole con ingenti perdite economiche e hanno dimostrato di essere in grado di infettare un’ampia gamma di specie di uccelli selvatici e mammiferi, compreso l’uomo (1).
Fino al 1997, i virus ad alta virulenza HPAI erano confinati al pollame, e i focolai potevano essere controllati con l’abbattimento degli animali infetti e la vaccinazione preventiva dei sani; fino ad allora i virus HPAI del pollame non si erano diffusi ai volatili selvatici e quest’ultimi non avevano avuto nessun ruolo nella trasmissione ai volatili domestici (1).
Le continue moltiplicazioni e i frequenti eventi di riassortimento tra i virus HPAI H5 del lineage Gs/Gd e i virus LPAI circolanti negli uccelli selvatici, hanno contribuito a modificare profondamente la sequenza genetica codificante l’emoagglutinina HA. Questo processo ha portato alla formazione di numerose linee evolutive distinte, denominate “clade” e “subclade”: cioè gruppi di virus strettamente correlati tra loro che condividono caratteristiche genetiche simili e che si sono evoluti da un antenato comune (1).
Dalla fase inziale circoscritta al Sud-est asiatico, il virus ha rapidamente esteso il proprio raggio d’azione. Fin dal 2003 infatti, i virus HPAI H5 Gs/Gd sono diventati enzootici in diversi paesi dell’Asia meridionale e sud-orientale (1). Un punto di svolta si è verificato nel 2005 con il primo grande evento di mortalità di massa di uccelli migratori nel Lago Qinghai, in Cina, che ha segnato l’inizio della diffusione intercontinentale del lineage Gs/Gd e la comparsa per la prima volta in Europa e in Africa durante la migrazione autunnale degli uccelli (1).
Dal 2005 i virus HPAI si sono diffusi su larga scala in Asia, Europa, Africa e Nord America, diventando una minaccia globale per il pollame e per le specie di uccelli selvatici in via di estinzione. Al tempo stesso è aumentato il rischio zoonotico con 976 infezioni umane confermate dal 2003 fino a maggio 2025, con 470 morti, tra cui il primo decesso negli USA in seguito al contatto con pollame infetto, la cui notizia è stata diffusa il 6 gennaio 2025. In Europa risultano attualmente solo 6 infezioni umane tutte verificatesi recentemente nel Regno Unito (2).
Ad assumere un ruolo dominante tutt’oggi nel mondo, è stato il clade 2.3.4.4, comparso in Cina nel 2008. Questo clade si è reso responsabile delle più gravi ondate epidemiche di influenza aviaria HPAI in Europa: negli anni 2016-2017, 2020-2021, 2021-2022, 2022-2023 (3) e 2023-2024 (4) con gravi morie nei volatili domestici e selvatici e con il coinvolgimento sporadico di diverse specie di mammiferi, nell’ondata 2020-2021, fino ad oggi. Nell’estate 2022 inoltre, sono state osservate gravi morie di uccelli selvatici, compresi quelli marini che in passato non erano mai stati coinvolti (3).
Impatto globale
A partire da gennaio 2021, un virus A(H5N1) strettamente correlato a quelli che circolavano in Europa durante l’epidemia 2020–2021 si è diffuso in Africa occidentale, raggiungendo successivamente anche i Paesi dell’Africa meridionale (3). Alla fine dello stesso anno, alcuni virus A(H5N1) appartenenti al clade 2.3.4.4b, geneticamente affini a quelli identificati nel Nord Europa, sono stati segnalati anche nell’Asia meridionale e orientale, oltre che in Nord America. All’inizio del 2022, un nuovo ingresso del virus A(H5N1), questa volta proveniente dal Giappone, è stato documentato in Nord America: qui il virus ha rapidamente acquisito nuovi segmenti genetici attraverso riassortimenti con virus LPAI endemici nei volatili selvatici americani (3).
Nello stesso anno, in ottobre, il virus ha raggiunto anche il Messico e, subito dopo, il Sud America, provocando eventi di mortalità di massa non solo nel pollame e negli uccelli selvatici, ma anche in diverse specie di mammiferi, inclusi i mammiferi marini. Le coste atlantiche e quelle pacifiche delle Americhe sono state colpite da un’epizoozia senza precedenti, soprattutto in Argentina, Cile e Perù, con episodi di trasmissione da mammifero a mammifero (5).
Il quadro complessivo delineato dall’Organizzazione Mondiale per la Salute Animale (WOAH) riflette chiaramente la portata della trasmissione intercontinentale del lineage HPAI H5 Gs/Gd: tra il 2005 e il 2024, questi virus hanno determinato la perdita, per mortalità o abbattimento, di circa 633 milioni di volatili da allevamento, con un picco di 146 milioni nel solo 2022, e hanno avuto una costante espansione geografica, raggiungendo per la prima volta l’America latina e l’Antartide (6) (7).
La persistente circolazione dei virus del clade 2.3.4.4b ha favorito l’emergere di numerosi genotipi virali, risultato di frequenti riassortimenti tra virus HPAI e LPAI. Ogni nuovo genotipo presenta una combinazione unica dei suoi otto segmenti genomici (PB2, PB1, PA, HA, NP, NA, NS, M), con potenziali implicazioni sia per la patogenicità sia per l’adattamento a nuovi ospiti (3).
Secondo quanto riportato nel documento Avian Influenza Overview September–December 2024 (4) redatto da EFSA, ECDC e dal Laboratorio di Referenza dell’Unione Europea per l’influenza aviaria e la malattia di Newcastle (EURL AI/ND) dell’IZS delle Venezie (IZSVe), durante i mesi autunnali del 2024, in coincidenza con l’inizio della stagione migratoria, si è registrato un nuovo aumento dei casi di influenza aviaria negli uccelli selvatici lungo le coste dell’Europa. Tuttavia, il numero complessivo di casi è rimasto inferiore rispetto agli stessi periodi del 2022 e del 2023 (4). Le aree maggiormente interessate sono risultate quelle dell’Europa centro-meridionale, caratterizzate da un’elevata densità di allevamenti avicoli. In particolare, il virus A(H5N5), responsabile di eventi di mortalità negli uccelli selvatici, ha ampliato il proprio areale sia in termini geografici sia di specie ospiti coinvolte, interessando 17 specie di uccelli tra cui il gabbiano reale nordico, il mugnaiaccio e il corvo.
In Europa, da dicembre 2024 a marzo 2025, i virus HPAI (H5N1) sono stati osservati in 31 paesi, maggiormente nella parte centrale, occidentale e sud-orientale e gli uccelli selvatici maggiormente coinvolti sono stati gli Anseriformes, tra cui i cigni e le oche; il contatto degli uccelli selvatici con il pollame allevato all’aperto resta il più grande fattore di rischio (7).
Contesto italiano e il caso del gabbiano reale positivo nella regione Abruzzo
In Italia, durante i mesi autunnali del 2024, secondo il sopra citato documento Avian Influenza Overview September–December 2024 (4), sono riportati 23 focolai nel pollame (22 primari e 1 secondario), tutti nel Nord Italia. La peculiarità dell’ultima ondata epidemica consiste nel maggiore interessamento dei piccoli allevamenti rurali, in particolare nella provincia di Treviso dove non ci sono grosse concentrazioni di aziende di pollame, ma strutture facilmente accessibili ai volatili selvatici. Nello stesso periodo, a livello europeo, si è osservato un aumento significativo dei casi negli uccelli selvatici: il numero di esemplari colpiti è risultato triplicato rispetto al trimestre precedente e superiore di circa un terzo rispetto allo stesso periodo dell’anno epidemiologico precedente. Ad essere maggiormente interessati sono stati gli uccelli dell’ordine Anseriformi, raccolti prevalentemente lungo i grandi fiumi europei come il Danubio, l’Oder e il Po, e in misura minore i Caradriiformi marini, rilevati lungo le coste dell’Artico, dell’Atlantico, del Mare del Nord e, più localmente, dell’Adriatico (4).
All’interno di questo quadro complesso, un caso emblematico si è verificato in Abruzzo, dove per la prima volta è stata rilevata la presenza del virus HPAI A(H5N1) in un uccello selvatico rinvenuto sul territorio regionale. Si tratta di un gabbiano reale zampegialle (Larus michahellis), rinvenuto moribondo a fine novembre 2024 nel centro abitato di Ortona dei Marsi (AQ) (Figura 1), un borgo medievale immerso nel Parco Nazionale d’Abruzzo, Lazio e Molise, nello specifico nella Marsica, regione storico-geografica dell’entroterra abruzzese.
L’animale, un giovane maschio del secondo anno (Giulia Pace, Rewilding Apennines, comunicazione personale), pesava circa 850 grammi e presentava un’apertura alare di circa 140 cm (Figura 2 A e B).
Presso la sede diagnostica territoriale di Avezzano dell’Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise (IZS Teramo) è stato eseguito l’esame anatomopatologico ed applicato l’iter diagnostico previsto dal Programma Nazionale di Sorveglianza per l’Influenza Aviaria 2024. Il real-time RT-PCR per la ricerca dell’RNA virale del gene M, eseguita su cervello, trachea, polmoni e intestino presso il Reparto Virologia dell’IZS Teramo, ha confermato la positività al virus HPAI A(H5N1). I campioni sono stati successivamente inviati al Laboratorio di Referenza Nazionale ed Europeo (EURL AI/ND) presso l’IZSVe, dove sono stati eseguiti l’isolamento virale, il sequenziamento genomico completo e l’analisi filogenetica. Il virus è stato identificato come appartenente al clade 2.3.4.4b, genotipo DI.2.
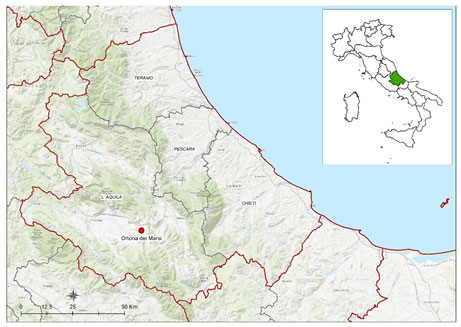
Figura 1.Mappa con il sito di rinvenimento del gabbiano reale positivo al virus dell’influenza aviaria HPAI H5N1 nel comune di Ortona dei Marsi (AQ) nella regione Abruzzo.

Figura 2a.Gabbiano reale positivo al virus dell’influenza aviaria HPAI A (H5N1), vista ventrale.

Figura 2b.Gabbiano reale positivo al virus dell’influenza aviaria HPAI A (H5N1), vista dorsale.
Il ritrovamento di un gabbiano reale in un’area montana dell’Italia centrale, lontana da habitat marini o lacustri, non rappresenta un evento eccezionale: questa specie è infatti nota per la sua capacità di adattamento ad ambienti urbani e periurbani, compresi i centri abitati montani, le discariche e le aree agricole. I giovani individui, in particolare, presentano una forte tendenza alla dispersione erratica, che rende complessa l’identificazione dell’area di provenienza.
Considerata l’assenza di focolai attivi di influenza aviaria in Abruzzo e nell’Italia Centrale al momento del ritrovamento, è plausibile che l’esemplare provenisse dall’Alto Adriatico, dove erano presenti focolai confermati, e stesse migrando verso il basso Mar Tirreno. Questa ipotesi è supportata da precedenti studi sulle rotte migratorie del gabbiano reale, condotti mediante tecniche di inanellamento (8).
Altri 15 gabbiani reali zampegialle positivi al virus HPAI A(H5N1) sono stati identificati nel corso dell’anno epidemiologico 2024–2025, tra il 25 ottobre 2024 e il 6 marzo 2025, in diverse province italiane, tra cui Venezia, Padova, Macerata, Verona, Bologna, Parma e Rimini. I casi precedenti già documentati risalivano agli anni 2021–2022 (4 in Veneto, 1 a Napoli) e 2022–2023 (4 in Veneto, 1 in Emilia-Romagna).
Nell’Italia centro-meridionale altre specie aviarie selvatiche sono risultate colpite negli ultimi anni: tra il 2021 e il 2024, sono stati segnalati casi in rapaci (province di Salerno, Napoli e Perugia), in un cigno reale e in un beccapesci (provincia di Macerata) (9).
Tutti i dati aggiornati sulla circolazione virale nei volatili sono disponibili sul portale Avian Flu Data Portal dell’EURL AI/ND (EURL AI/ND, 2025. Avian Flu Data Portal https://eurlaidata.izsvenezie.it/).
Nuove specie colpite e spillover nei mammiferi
Negli ultimi anni, i virus HPAI, in particolare nella forma causata dal sottotipo H5N1 del clade 2.3.4.4b, hanno mostrato una preoccupante capacità di espandere il proprio spettro di ospiti, andando ben oltre gli uccelli domestici e selvatici. A partire da novembre 2020, sono stati segnalati numerosi eventi di spillover nei mammiferi, distribuiti in diverse regioni del mondo e in contesti ecologici eterogenei.
Fino a settembre 2024, sono stati documentati oltre 700 casi di infezione da virus HPAI in 73 specie diverse di mammiferi, esclusi gli esseri umani. Le famiglie tassonomiche più frequentemente colpite comprendono i canidi, i felidi, i piccoli carnivori, i mammiferi marini e, più recentemente, anche i bovidi, in particolare i bovini da latte negli Stati Uniti (10).
Per la prima volta dalla primavera del 2024, ci sono stati molti rilevamenti di virus HPAI nei gatti domestici e nei carnivori selvatici in Europa (7).
L’evoluzione genetica del virus, facilitata da eventi di riassortimento e da una pressione selettiva costante in ambienti ad alta densità animale, sembra aver aumentato la capacità del virus di infettare specie non aviarie, con implicazioni importanti sia per la salute animale che per la salute pubblica. Alcuni di questi casi hanno coinvolto lavoratori esposti, che hanno sviluppato forme lievi della malattia, e il rilevamento di infezioni in specie-ponte come i suini, ha riacceso il timore di una possibile emergenza pandemica.
Di seguito, i principali eventi segnalati a livello globale:
- Marzo 2024, Texas (USA) – Primo isolamento di HPAI H5N1 clade 2.3.4.4b in bovini da latte con ipogalattia. Identificato il genotipo B3.13, derivato da un evento di trasmissione da uccello selvatico (11).
- 6 gennaio 2025 Lousiana (USA)-Il primo decesso umano da HPAI H5N1 negli Stati Uniti, associato al genotipo DI.1, ha rafforzato l’allerta internazionale riguardo al potenziale pandemico del virus (12).
- 27 gennaio 2025, West Midlands, (Regno Unito) Isolamento del virus in un uomo sintomatico, operatore in una azienda di polli infetti da HPAI H5N1 clade 2.3.4.4b genotipo DI.2. Il genotipo DI è quello che ha circolato maggiormente in Europa nell’ondata epidemica 2024-2025 (13).
- 31 gennaio 2025, Nevada (USA) – Secondo evento indipendente di trasmissione diretta da uccello selvatico a bovino, con isolamento del virus genotipo D1.1, già diffuso tra uccelli migratori, pollame e mammiferi marini (14).
- 13 febbraio 2025, Arizona (USA) – Terzo evento, simile a quello del 31 gennaio 2025, con isolamento di un virus D1.1 geneticamente distinto dal precedente, confermando la possibilità di più introduzioni indipendenti da fauna selvatica (14).
- 24 marzo 2025, Yorkshire (Regno Unito), Europa. Primo isolamento del virus di HPAI H5N1 clade 2.3.4.4b dal latte di una pecora (16).
Il gruppo FAO-WHO-WOAH ha dichiarato nel suo documento del 17 aprile 2025 (14), che il rischio di una emergenza dei virus influenzali A (H5N1) è basso per il pubblico in generale, mentre è valutato da basso a moderato per le persone esposte per motivi professionali, a seconda delle misure di mitigazione del rischio in atto e della situazione epidemiologica locale dell’influenza aviaria. Attualmente non è documentata la trasmissione sistematica del virus dell’influenza aviaria da uomo a uomo, anche se in passato è stata osservata sporadicamente tra le persone infette e quelle che le accudivano (14).
Evoluzione genetica del virus: mutazioni recenti e genotipi emergenti
Nel corso dell’anno epidemiologico 2023–2024, la sorveglianza genetica condotta sui virus HPAI A(H5Nx) circolanti in Europa ha evidenziato un quadro in evoluzione, con l’emergere e la diffusione di nuovi genotipi, ma una relativa stabilità nelle mutazioni critiche associate all’adattamento umano.
Nel periodo settembre–dicembre 2024, i genotipi predominanti in Europa sono stati quattro:
- A(H5N1) EA-2022-BB
- A(H5N1) EA-2023-DT
- A(H5N1) EA-2024-DI
- A(H5N5) EA-2021-I
Tra questi, ha assunto un ruolo centrale il genotipo EA-2024-DI, emerso alla fine del 2023 e diffusosi inizialmente in Europa orientale. Da settembre 2024, questo genotipo è divenuto il più frequentemente rilevato in Europa, in particolare nell’Europa centrale e orientale. Le analisi molecolari hanno rivelato la presenza di due sottogruppi del genotipo DI: DI.1 e DI.2. Entrambi sono stati isolati in Austria, Germania, Italia e Regno Unito, ma con una distribuzione geografica differenziata tra i Paesi europei (4).
Dall’ottobre 2024 a marzo 2025 è stata studiata la sequenza completa di circa 600 virus HPAI a (H5) clade 2.3.4.4b isolati prevalentemente dagli uccelli domestici e dagli Anseriformi, e l’85% risulta appartenere al genotipo EA-2024-DI, di cui il 90% del sottotipo DI.2 (7).
Dal punto di vista delle mutazioni di rilevanza zoonotica, le analisi molecolari dei virus circolanti negli uccelli da ottobre 2023 a marzo 2025, non hanno rilevato variazioni critiche nel sito di clivaggio della proteina emoagglutinina HA, come quelle osservate in precedenti pandemie influenzali; i virus circolanti quindi mantengono una forte specificità per le specie aviarie (4; 7).
Da ottobre 2024 in 35 virus isolati da volatili in Europa, sono state osservate alcune mutazioni nella proteina PB2 che aumentano l’adattabilità del virus ai mammiferi; rispetto all’anno epidemiologico 2023-2024, sembra ci sia stato un aumento di frequenza di mutazioni in questa proteina (7).
Per quanto riguarda i virus isolati nei bovini negli Stati Uniti, le analisi genetiche sui genotipi B3.13 e D1.1, isolati fino alla data del 1° marzo 2025 solo nel Nord America, hanno mostrato caratteristiche diverse:
- Alcuni virus D1.1 isolati da bovini presentano una mutazione nella proteina PB2 che aumenta l’attività replicativa nelle cellule di mammifero, ma questa mutazione non è presente negli isolati degli uccelli selvatici e del pollame (14).
- Alla data del 1° marzo 2025, nessuno dei virus isolati dai bovini possiede mutazioni nel gene HA che aumentino significativamente la capacità del virus di legarsi ai recettori umani (14).
- Sporadicamente sui genotipi isolati dai casi umani, sono state osservate mutazioni che compromettano l’efficacia dei principali farmaci antivirali utilizzati in ambito umano (14).
ll rischio di introduzione del genotipo B3.13 in Europa è alto e in un recente rapporto scientifico l’EFSA ha individuato la possibile entrata dei virus nei paesi europei attraverso sia la migrazione degli uccelli Anseriformi passanti per l’Artide Nordamericano, e sia con l’importazione delle bovine da latte, della carne bovina e degli alimenti a base di latte crudo (15).
Strategie di controllo e risposta integrata: l’approccio europeo e italiano alle infezioni da virus HPAI
Il potenziale pandemico di questi virus richiede una attenta vigilanza specialmente nelle popolazioni animali dove la trasmissione tra pollame e mammiferi è stata osservata. Per questo motivo è fondamentale che gli allevatori rafforzino le misure di biosicurezza nelle loro aziende, che i governi si impegnino a far applicare misure per ridurre o eliminare la trasmissione tra gli animali e la contaminazione ambientale, e a comunicare in modo chiaro il rischio alle persone che lavorano negli allevamenti, affinché utilizzino adeguati dispositivi di sicurezza individuale (14).
In questo scenario, la risposta internazionale si è evoluta. La FAO e la WOAH hanno aggiornato nel 2024 la strategia globale per l’influenza aviaria HPAI (2024–2033), sostituendo quella del 2008, per rispondere all’emergere continuo di nuovi ceppi del lineage H5 Gs/Gd (17). Il nuovo piano adotta un’impostazione One Health, che promuove partenariati pubblico-privati, l’uso di strumenti innovativi e una maggiore integrazione tra i settori della sanità animale, umana e ambientale.
Il WHO Global Influenza Surveillance and Response System (GISRS), in collaborazione con gli organismi internazionali della sanità animale (FAO, WOAH, OFFLU ed altri) continuano a valutare i virus candidati per i vaccini al fine di arrivare preparati ad una eventuale pandemia (14).
Per contrastare la diffusione dei virus dell’influenza aviaria HPAI, tutti i Paesi dell’Unione Europea applicano programmi di sorveglianza su pollame e avifauna selvatica, in conformità al regolamento (UE) 2016/429, in uno sforzo coordinato per la diagnosi precoce, il monitoraggio virologico e la prevenzione dei focolai, in un contesto reso sempre più complesso dai cambiamenti ecologici, climatici ed epidemiologici globali. Recentemente l’Unione Europea ha rafforzato il proprio sistema di sorveglianza, aggiornando le linee guida tecniche e promuovendo scenari di risposta coordinata, sviluppati congiuntamente da EFSA, ECDC ed EURL AI/ND. A gennaio 2025, queste agenzie hanno pubblicato un parere scientifico (18) e un manuale operativo One Health, che include diagrammi di flusso per affrontare cinque possibili scenari epidemici zoonotici (19).
In Italia, il sistema informativo veterinario nazionale SIMAN, accessibile tramite il portale del Sistema Informativo Veterinario (Vetinfo), integra diversi sistemi di sorveglianza veterinaria per supportare la notifica digitale dei focolai di influenza aviaria. Include strumenti Web GIS per la visualizzazione in tempo reale e la mappatura del rischio, facilitando così una risposta rapida da parte dei servizi veterinari (https://www.vetinfo.it).
La strategia nazionale italiana, si concretizza nel Programma di Sorveglianza per l’Influenza Aviaria – 2024, adottato con decreto del Ministero della Salute del 30 maggio 2023 (20) Il programma integra sorveglianza attiva e passiva su pollame e fauna selvatica, secondo le disposizioni europee. Le province italiane sono classificate per rischio epidemiologico: le province abruzzesi e quelle del centro-sud d’Italia sono considerate a basso rischio, mentre quelle delle regioni settentrionali (Lombardia, Veneto, Emilia-Romagna, Piemonte) ospitano il 70% degli allevamenti avicoli e sono ad alto rischio.
I dati nazionali vengono trasmessi all’ EURL AI/ND (IZSVe), che li include nei rapporti tecnici trimestrali redatti con EFSA ed ECDC (4; 7). Proprio in risposta al rischio zoonotico crescente, il Ministero della Salute ha recepito le indicazioni comunitarie, diffondendo una circolare operativa nel 2025 alle autorità sanitarie e veterinarie (21).
Il rafforzamento della cooperazione interdisciplinare, l’adozione di strumenti di risposta flessibili e l’integrazione tra livelli locali, nazionali e internazionali costituiscono oggi gli elementi chiave per contenere il rischio HPAI e prepararsi a future minacce epidemiche.
Ringraziamenti
Desideriamo ringraziare Valentina Zenobio e Francesca Dall’Acqua per il loro supporto nella revisione scientifica e nell’organizzazione dei contenuti.
Bibliografia
- Verhagen J.H., Fouchier R.A.M. & Lewis N. 2021. Highly Pathogenic Avian Influenza Viruses at the Wild-Domestic Bird Interface in Europe: Future Directions for Research and Surveillance. Viruses, 13(2), 212. doi: 10.3390/v13020212.
- WHO, 2025. Cumulative number of confirmed human cases for avian influenza A (H5N1) reported to WHO, 2003-2025. https://www.who.int/publications/m/item/cumulative-number-of-confirmed-human-cases-for-avian-influenza-a(h5n1)-reported-to-who--2003-2025--27-may-2025)
- Fusaro A., Zecchin B., Giussani E., et al. 2024. High pathogenic avian influenza A(H5) viruses of clade 2.3.4.4b in Europe-Why trends of virus evolution are more difficult to predict. Virus Evol, 10(1), veae027.
- EFSA (European Food Safety Authority), ECDC (European Centre for Disease Prevention and Control), EURL (European Union Reference Laboratory for Avian Influenza), Alexakis L., Buczkowski H., Ducatez M. et al. 2025. Scientific report: Avian influenza overview September–December 2024. EFSA J, 23(1), 9204. https://doi.org/10.2903/j.efsa.2025.9204
- FAO-WHO-WOAH. 2024. Updated joint FAO/WHO/WOAH public health assessment of recent influenza A (H5) virus events in animals and people Assessment based on data as of 18 November 2024. 20 December 2024. https://www.woah.org/app/uploads/2024/12/cleared-2024-12-10-fao-woah-who-h5n1-assessment-woah-fao.pdf
- World Organisation for Animal Health (WOAH). 2025. High Pathogenicity Avian Influenza (HPAI) Situation Report 67. 2025. https://www.woah.org/app/uploads/2025/02/hpai-report-67.pdf)
- EFSA, 2025. European Food Safety Authority; European Centre for Disease Prevention and Control; European Union Reference Laboratory for Avian Influenza; Alexakis L, Buczkowski H, Ducatez M, Fusaro A, Gonzales JL, Kuiken T, Ståhl K, Staubach C, Svartström O, Terregino C, Willgert K, Melo M, Kohnle L. Avian influenza overview December 2024-March 2025. EFSA J. 2025 Apr 15;23(4):e9352. doi: 10.2903/j.efsa.2025.9352. PMID: 40236376; PMCID: PMC11997622.
- Spina F. & Volponi S. 2008. Gabbiano reale (Larus michaellis) In: Atlante della Migrazione degli Uccelli in Italia. Vol.1. non-Passeriformi. Ministero dell’Ambiente e della Tutela del Territorio e del Mare, Istituto Superiore per la Protezione e la Ricerca Ambientale (ISPRA), 640-646.
- IZS delle Venezie, 2025. Influenza aviaria: situazione epidemiologica in Italia- HPAI. https://www.izsvenezie.it/temi/malattie-patogeni/influenza-aviaria/situazione-epidemiologica-hpai/
- EFSA Panel on Animal Health and Animal Welfare, ECDC, Alvarez, J., Boklund, A., Dippel, S., et al. 2025. Preparedness, prevention and control related to zoonotic avian influenza. EFSA J, 23(1), e9191. https://doi.org/10.2903/j.efsa.2025.9191
- United States Department of Agriculture (USDA). 2024. Federal and State Veterinary, Public Health Agencies Share Update on HPAI Detection in Kansas, Texas Dairy Herds. 25 March 2024. https://www.aphis.usda.gov/news/agency-announcements/federal-state-veterinary-public-health-agencies-share-update-hpai
- CDC, 2025. First H5 Bird Flu Death reported in United States. https://www.cdc.gov/media/releases/2025/m0106-h5-birdflu-death.html)
- DEFRA, 2025. Human case of avian flu detected in England. https://www.gov.uk/government/news/human-case-of-avian-flu-detected-in-england) (overview settembre dicembre 2024
- FAO-WHO-WOAH. 2025. Updated joint FAO/WHO/WOAH public health assessment of recent influenza A (H5) virus events in animals and people Assessment based on data as of 1 March 2025. 17 April 2025
- European Food Safety Authority (EFSA); Alvarez J, Bortolami A, Ducatez M, Guinat C, Stegeman JA, Broglia A, Jensen H, Kryemadhi K, Gervelmeyer A. Risk posed by the HPAI virus H5N1, Eurasian lineage goose/Guangdong clade 2.3.4.4b. genotype B3.13, currently circulating in the US. EFSA J. 2025 Jul 3;23(7):e9508. doi: 10.2903/j.efsa.2025.9508. PMID: 40611987; PMCID: PMC12223544.
- DEFRA, 2025. Influenza of avian origin confirmed in a sheep in Yorkshire. https://www.gov.uk/government/news/influenza-of-avian-origin-confirmed-in-a-sheep-in-yorkshire
- FAO and World Organisation for Animal Health. 2025. Global Strategy for the Prevention and Control of High Pathogenicity Avian Influenza (2024–2033) – Achieving sustainable, resilient poultry production systems. Rome. https://doi.org/10.4060/cd3840en
- EFSA Panel on Animal Health and Animal Welfare, ECDC, Alvarez, J., Boklund, A., Dippel, S., et al. 2025. Preparedness, prevention and control related to zoonotic avian influenza. EFSA J, 23(1), e9191. https://doi.org/10.2903/j.efsa.2025.9191
- European Centre for Disease Prevention and Control, European Food Safety Authority, Hallmeier-Wacker L, Enkirch T, Melidou A, Willgert K and Gervelmeyer A, 2025. Coordinated One Health investigation and management of outbreaks in humans and animals caused by zoonotic avian influenza viruses– January 2025. ISBN 978-92-9498-765-5; doi: 10.2900/4758784 Catalogue number TQ-01-24-021-EN-N doi: 10.2903/j.efsa.2025.9183
- Decreto 30 maggio 2023. Adozione del programma di sorveglianza dell’Unione europea per l’influenza aviaria nel pollame e nei volatili selvatici. G.U. n. 151, 30/06/2023.
- Ministero della Salute. Circolare 2627-29/01/2025-DGPRE-DGPRE-P. Focolai di Influenza Aviaria da sottotipo H5N1: aggiornamento situazione epidemiologica e indicazioni di sanità pubblica.
Elga Ersilia Tieri1, Berardina Costantini1, Stefania Centi1, Marzia Ciminelli1, Ambra Ciminelli1, Sandro Pelini1, Annamaria Sansone1, Nadia Sulli1, Ilaria Puglia1,2, Marialuigia Caporale1,2, Tetyana Petrova1, Leonardo Gentile3, Stefania Salucci1
1 Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise “G. Caporale”
2PhD National Programme in One Health approaches to infectious diseases and life science research, Department of Public Health, Experimental and Forensic Medicine, University of Pavia, 27100, Italy
3Parco Nazionale d’Abruzzo Lazio e Molise, Servizio Veterinario, Pescasseroli (AQ)