L’emergente allarme mondiale per l’antifungino resistenza
I funghi sono una componente chiave dei cicli biogeochimici globali, svolgendo ruoli importanti nelle industrie manifatturiere e nella ricerca biomedica e influenzando l'uomo grazie al loro impatto sulla salute globale, sull'agricoltura e sulla biodiversità. I funghi sono stati isolati da quasi tutte le nicchie ambientali del pianeta, tra cui aria, suolo, acque dolci e oceani. Tradizionalmente, sono identificati in base alle loro caratteristiche morfologiche ma, con il progresso della biologia molecolare e delle tecniche di sequenziamento, l'identificazione e la caratterizzazione delle specie fungine sono diventate sempre più dipendenti dai polimorfismi del DNA e dal genoma mitocondriale. I genomi fungini tendono a essere altamente plastici ed evolutivi, con un'ampia diversità genetica tra gli isolati naturali, che rappresenta una delle ragioni principali per cui la resistenza antimicotica può evolvere così rapidamente in questi microorganismi (Shang Sun et al., 2022).
Mentre la stragrande maggioranza dei funghi non è patogena, un numero limitato di essi può causare gravi malattie nelle piante e negli animali (compreso l'uomo), con effetti devastanti sulla salute pubblica, sull'agricoltura e sulla biodiversità con relative conseguenze socioeconomiche.
Infatti, le infezioni fungine, denominate micosi, stanno diventando sempre più un problema sanitario globale, associato ad alti tassi di morbilità e mortalità. I funghi possono essere responsabili di micosi superficiali che generalmente richiedono un semplice trattamento farmaceutico, ma anche di micosi invasive (Braun et al., 2012). In virtù di questo, la gravità varia da infezioni mucocutanee asintomatiche-moderate a infezioni sistemiche potenzialmente pericolose per la vita. La mortalità associata alle malattie fungine è stata stimata essere di circa 1,7 milioni di morti all'anno, simile a quella della tubercolosi e tre volte superiore a quella causata dalla malaria (Bongomin et al., 2017).
L'aumento dell'incidenza delle micosi nell'ultimo decennio è legato a microrganismi patogeni fungini sempre più resistenti ai trattamenti antimicotici. Le infezioni fungine gravi si verificano principalmente in soggetti immunosoppressi, come i pazienti colpiti dal virus dell'immunodeficienza umana (HIV), i soggetti con disturbi endocrino-metabolici o quelli sottoposti a chemioterapia antineoplastica o a terapia immunosoppressiva dopo un trapianto d'organo (Vitiello et al., 2023).
In Tabella 1 sono riportati i dati di incidenza annuale e conseguente impatto globale delle principali malattie fungine.
I funghi possono sopravvivere sulle superfici per settimane e alcuni dei disinfettanti comunemente utilizzati negli ospedali spesso non sono efficaci. Inoltre, la facilità di diffusione dei microrganismi dovuta al commercio globale, all'alta frequenza dei viaggi e ai cambiamenti climatici, rende le infezioni fungine difficilmente controllabili.
Tabella 1. Incidenza annuale e prevalenza globale delle principali micosi
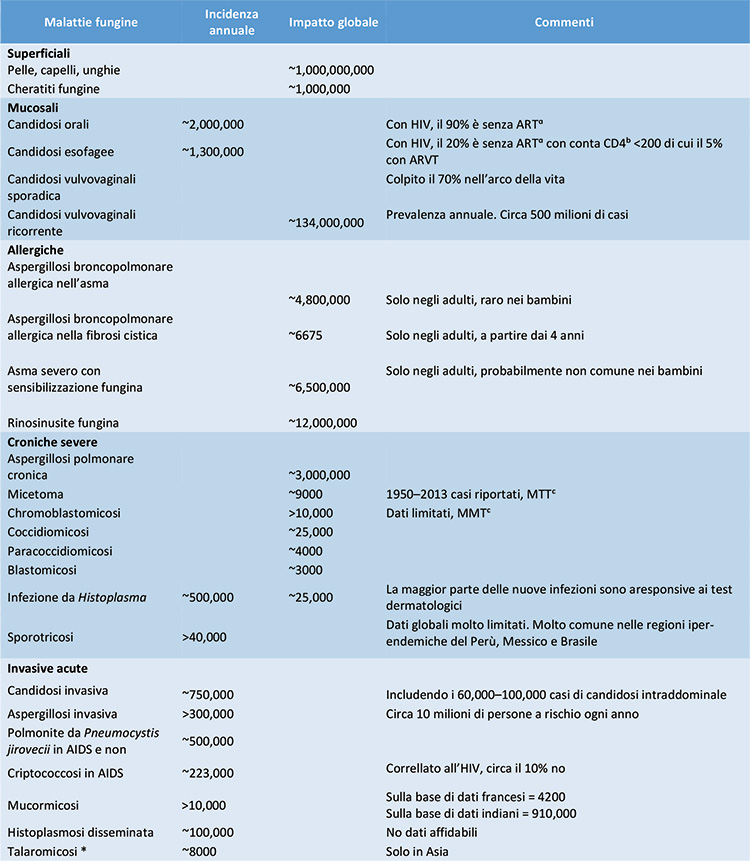
ART: aderenza alla terapia antiretrovirale; CD4ᵇ = conta linfocitaria; MTTᶜ = Malattie tropicali trascurate – WHO
Tra i patogeni fungini maggiormente responsabili di micosi sistemiche gravi vi sono i ceppi di Candida albicans, Candida glabrata e Aspergillus spp. In particolare, i funghi della specie Aspergillus sono molto persistenti nell'ambiente ospedaliero e causano un'ampia gamma di infezioni, tra cui quelle sistemiche potenzialmente letali, soprattutto nei pazienti con grave compromissione del sistema immunitario (Vitiello et al., 2023). Recentemente, l'Organizzazione Mondiale della Sanità (WHO) ha sviluppato la prima lista di patogeni fungini prioritari (FPPL) che comprende i 19 funghi che rappresentano la maggiore minaccia per la salute pubblica, suddivisi in tre categorie: priorità critica, alta e media (Figura 1) (WHO, 2022).
- Il gruppo a priorità critica comprende quattro patogeni: Cryptococcus neoformans, Candida auris, Candida albicans e Aspergillus fumigatus.
- Il gruppo ad alta priorità comprende sette patogeni: Nakaseomyces glabrata (Candida glabrata), Histoplasma spp., agenti causali di eumicetoma, Mucorales, Fusarium spp., Candida tropicalis e Candida parapsilosis.
- Il gruppo a media priorità comprende otto patogeni ma, alcuni di questi, sono presenti limitatamente a determinate aree geografiche e quindi, non considerati prioritari a livello globale. Tuttavia, nelle aree in cui sono endemici sono associati ad un gravoso numero di micosi. Un esempio è Paracoccidioides spp., un fungo dimorfo endemico nel sud e nel centro America che vive nel suolo, responsabile di un tasso di mortalità tra il 3% e 23%.
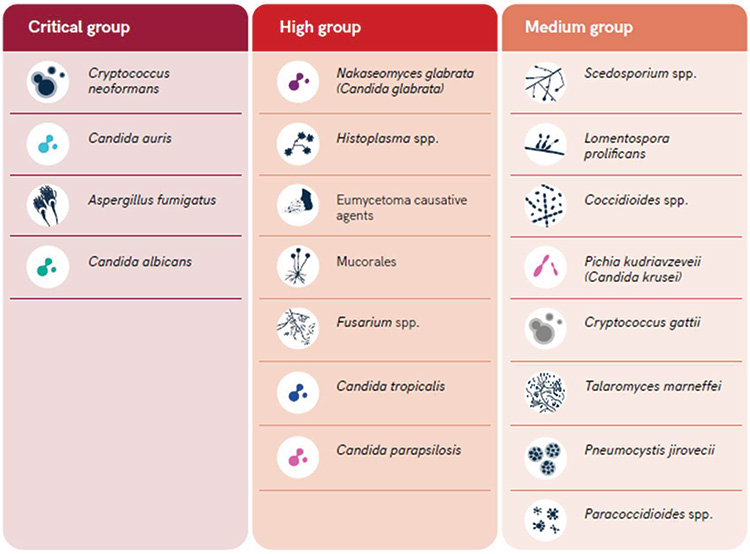
Figura 1. Lista WHO dei patogeni fungini prioritari (2022)
L'esempio di Candida auris descrive bene il problema incalzante della resistenza antimicotica. C. auris sembra essere significativamente meno sensibile a una serie di disinfettanti sanitari standard e può essere facilmente trasmessa da paziente a paziente, caratteristica insolita per i patogeni fungini. Le opzioni farmacologiche per il trattamento antimicotico sono attualmente limitate a tre classi farmacologiche distinte: azoli, echinocandine e polieni. È allarmante notare che nell'1% degli isolati, C. auris è resistente a tutte e tre le classi di antimicotici, circa il 90% di tutti gli isolati è resistente ad almeno una classe di farmaci antifungini e circa il 30% ad almeno due classi. Purtroppo, la resistenza multifarmacologica si sta affermando anche in altri funghi, soprattutto nelle specie di Candida (i patogeni fungini più diffusi), come ad esempio nella Candida glabrata, dove è sempre più accertata la resistenza incrociata tra azoli ed echinocandine (Kainz et al., 2020).
In Tabella 2 si riporta, in dettaglio, la sensibilità dei principali funghi patogeni ad alcuni principi attivi con azione antifungina appartenenti alle tre classi di antimicotici (Vitiello et al., 2023).
Tabella 2. Incidenza annuale e prevalenza globale delle principali micosi
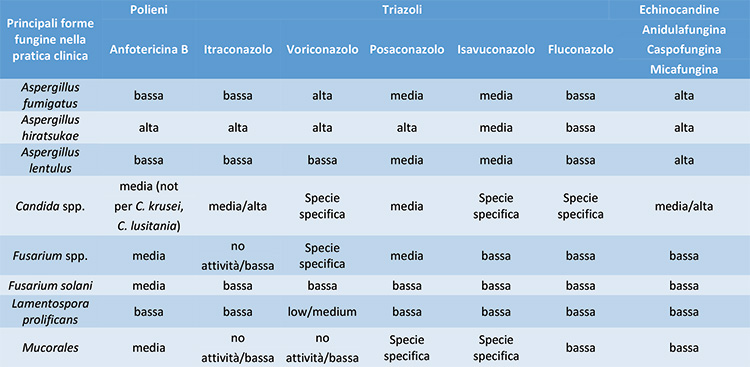
Gli azoli rappresentano il sottogruppo farmacologico clinicamente più rilevante, poiché la maggior parte di questi mostra un'efficacia comparabilmente elevata, bassa tossicità, capacità immunomodulatoria e la possibilità di assunzione orale (Campoy et al., 2017). Questi vantaggi hanno incoraggiato la loro applicazione terapeutica a lungo termine e l'uso profilattico in pazienti ad alto rischio, che a sua volta ha favorito l'aumento di ceppi meno sensibili.
Nel 2018, l'OMS ha lanciato un programma pilota di sorveglianza della Candida per raccogliere dati retrospettivi sulla resistenza agli antimicotici per gli isolati invasivi di Candida; questo è stato recentemente incluso formalmente nel programma Global Antimicrobial Resistance Surveillance System (GLASS). Oltre a questi programmi di sorveglianza più ampi e sistematici, sono disponibili dati di sorveglianza a livello nazionale per Candida spp. in diversi paesi come Australia, Scozia, Finlandia, Islanda, Norvegia, Svezia, Regno Unito e Danimarca (Astvad et al., 2018). Tuttavia, la sorveglianza di altre specie fungine è rara e la maggior parte dei dati pubblicati si limita all'A. fumigatus resistente agli azoli.
Esiste un legame di eco-evoluzione tra la resistenza ambientale e quella clinica nelle infezioni fungine e nei trattamenti che permette di sottolineare come questa minaccia emergente richieda un approccio One Health. Gli esseri umani sono esposti quotidianamente a funghi patogeni opportunistici che si trovano abitualmente negli ambienti di vita più vicini e l'intima relazione tra le popolazioni fungine comuni e la conseguente esposizione agli antimicotici fa sì che la resistenza ambientale emergente può influenzare la gestione clinica delle infezioni fungine.
Nell’ambiente agricolo, i funghi fitopatogeni sviluppano una continua resistenza alla gamma di fungicidi utilizzati contro di loro. I fungicidi utilizzati in agricoltura hanno un'attività ad ampio spettro in tutto il regno fungino e quindi la resistenza si manifesta non solo nei patogeni delle colture in sé, ma anche in altri funghi ambientali che includono potenziali patogeni fungini umani.
Un altro aspetto importante è rappresentato dalle temperature medie più elevate previste dagli scenari di cambiamento climatico, che possono influire sull'insorgenza della resistenza antifungina. I funghi rispondono alla temperatura regolando, ad esempio, la composizione dei lipidi della membrana cellulare, che a sua volta altera indirettamente la resistenza antimicotica, come dimostra l’elevata frequenza di resistenze agli azoli da parte di A. fumigatus in ambienti con temperature medie più alte come i paesi tropicali (Fisher et al., 2022).
Nella Figura 2, si riporta la prevalenza annuale dei casi di aspergillosi invasiva documentata in 37 Paesi, per un totale di circa 2.000 milioni di persone, circa il 29% della popolazione mondiale. Il più alto numero di persone infette si è osservata in Vietnam, con circa 14.523 casi in un anno (Bongomin et al., 2017).
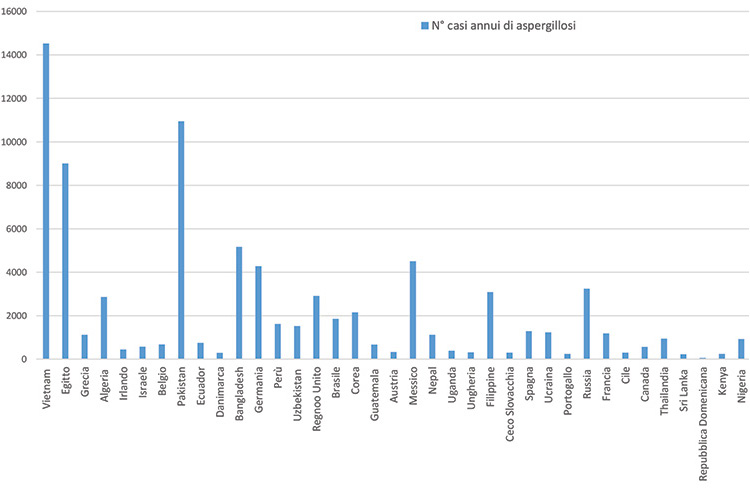
Figura 2. Stime pubbliche nazionali dei casi di aspergillosi invasiva
La minaccia imposta dalle infezioni fungine continuerà ad aumentare in tutto il mondo con una serie di ostacoli che devono essere superati con un'azione rapida e innovativa a diversi livelli. In primo luogo, è necessario intensificare la ricerca di opzioni terapeutiche: oltre a cercare all'interno della classica pipeline di farmaci antimicotici, si potrebbero trovare nuove strategie terapeutiche. Numerosi vaccini fungini sono stati studiati in ambito preclinico, ma solo il vaccino della proteina Als3 ricombinante di C. albicans ha mostrato risultati promettenti negli studi clinici di fase II (Edwards et al., 2018). In secondo luogo, i test di suscettibilità antimicotica devono essere ulteriormente standardizzati, poiché l'attuale mancanza di protocolli unificati causa discrepanze tra i laboratori e difficoltà nell'interpretazione dei dati ottenuti, rendendo difficile individuare l'opzione terapeutica ottimale per un paziente e aumentando la resistenza antimicotica. In terzo luogo, deve avvenire una sensibilizzazione sui problemi connessi alle infezioni fungine a livello sociale e governativo perché, nonostante l'enorme numero di infezioni letali, il loro impatto rimane relativamente sottovalutato (Kainz et al., 2020).
Lo sviluppo di analisi genomiche rapide è stato fondamentale per comprendere la trasmissione internazionale su scala locale di C. auris, compresa l'emergenza di varianti multiresistenti ai farmaci. L'implementazione del sequenziamento dell'intero genoma (WGS) è promettente ed è uno strumento utile per poter meglio esplorare le basi biologiche delle mutazioni geniche. Tuttavia, a differenza della resistenza agli antibatterici, un metodo standardizzato di tipizzazione WGS non è ancora comunemente utilizzato per i funghi a causa delle maggiori dimensioni del loro genoma, della frequente ricombinazione sessuale e della mancanza di pipeline bioinformatiche standardizzate (Fisher et al., 2022).
Bibliografia
- Astvad KMT, Johansen HK, Røder BL, et al. Update from a 12-year nationwide fungemia surveillance: Increasing intrinsic and acquired resistance causes concern | journal of clinical microbiology. Journal of Clinical Microbiology. 2018.
- Edwards John E. Jr, Schwartz Michael M, Schmidt Clint S, et al. A fungal immunotherapeutic vaccine (NDV-3A) for treatment of recurrent vulvovaginal Candidiasis—A phase 2 randomized, double-blind, placebo-controlled trial. Clinical Infectious Diseases. 2018;66(12):1928-1936.
- Duong Tra-My N, Le Thanh-Van, Tran Khanh-Linh, et al. Azole-resistant aspergillus fumigatus is highly prevalent in the environment of vietnam, with marked variability by land use type. Environmental Microbiology. 2021;23(12):7632-7642
- Perlin David S, Rautemaa-Richardson Riina, Alastruey-Izquierdo Ana. The global problem of antifungal resistance: Prevalence, mechanisms, and management. THE LANCET - Infectious diseasis. 2017;17(12):e383-e392. Ultima consultazione 24 novembre 2023. doi: https://doi.org/10.1016/S1473-3099(17)30316-X
- Campoy Sonia, Adrio Jose L. Antifungals. Science Direct. 2017. Ultima consultazione 24 novembre 2023
- Brown GD, Denning DW, Gow NAR, Levitz SM, Netea MG, White TC. Hidden killers: Human fungal infections. Sci Transl Med. 2012;4(165):165rv13. Ultima consultazione 24 novembre 2023
- WHO fungal priority pathogens list to guide research, development and public health
action. Geneva: World Health Organization; 2022. Licence: CC BY-NC-SA 3.0 IGO. In: 2022
- Castanheira M. Fungemia surveillance in Denmark demonstrates emergence of non-albicans candida species and higher antifungal usage and resistance rates than in other nations. Journal of clinical microbiology. 2018;56(4). doi: 10.1128/JCM.01907-17
- Sung Shen, HoyMichael J, Heitman Joseph. Fungal pathogens – Science Direct. 2020. Ultima consultazione 7 novembre 2023
- Kainz K, Bauer MA, Madeo F, Carmona-Gutierrez D. Fungal infections in humans: The silent crisis. Microb Cell. 2020;7(6):143-145. Ultima consultazione 17 ottobre 2023
- Vitiello A, Ferrara F, Boccellino M, et al. Antifungal drug resistance: An emergent health threat. Biomedicines. 2023;11(4):1063. doi: 10.3390/biomedicines11041063
- Bongomin F, Gago S, Oladele R, Denning DW. Global and multi-national prevalence of fungal Diseases—Estimate precision. JoF. 2017;3(4). doi: 10.3390/jof3040057
-
Fisher Matthew C, Alastruey-Izquierdo Ana, Berman Judith, et al. Tackling the emerging threat of
antifungal resistance to human health. Nature Reviews | MICROBIOlOGY. 2022;20. doi: https://doi.org/10.1038/ s41579-022-00720-1
Capone M. R.
Istituto Zooprofilattico Sperimentale dell’Abruzzo e del Molise “G. Caporale”
Centro Operativo Veterinario per l'Epidemiologia, Programmazione, Informazione e Analisi del Rischio (COVEPI)
Referente: m.capone@izs.it