La Febbre della Valle del Rift: una nuova minaccia per l’Europa, appena dietro l’angolo
Il virus della febbre della valle del Rift (Rift Valley fever - RVF) è un virus RNA a singola elica, appartenente all’ordine Bunyavirales, famiglia Phenuiviridae e genere Phlebovirus. La RVF è una malattia trasmessa da zanzare che interessa i ruminanti, sia domestici che selvatici, in particolare gli ovini, i bovini e le capre, ed è una zoonosi (OIE, 2019). La RVF è trasmessa principalmente da zanzare del genere Culex e Aedes (Balkhy et al., 2003).
La RVF è caratterizzata dalla comparsa dei c.d. “abortions storms”, con la comparsa di aborti anche nel 100% dei ruminanti recettivi che si trovano nel periodo della gravidanza. Inoltre è caratterizzata da una elevata mortalità nei giovani animali (Anyangu et al., 2010). I prodotti dell’aborto (feto abortito e placente) rappresentano le principali fonti d’infezione per l’uomo (Zeller et al., 1997).
La gravità della malattia può variare molto con la specie e la razza degli animali interessati e la mortalità è differente nelle diverse specie animali e a seconda dell’età. Gli ovini e le capre in genere si dimostrano più recettivi dei bovini. I dromedari di solito sviluppano un infezione inapparente, che però può talvolta mostrarsi con morti improvvise, mortalità neonatale e aborti, con frequenza paragonabili a quelle riscontrabili nei bovini (OIE, 2016). L’infezione nell’uomo può causare varie forme cliniche di malattia, da quelle più lievi a forme gravi, nelle quali si può avere febbre emorragica, encefalite, cecità e la morte del paziente (Ikegami et al., 2011).
Sebbene la RVF è considerata endemica nella maggior parte dell’Africa sub-sahariana, la malattia ha dato ripetute prove di essere in grado di fuoriuscire dalla sua area endemica e di diffondersi in nuovi territori, come è avvenuto nel 2000 in Arabia Saudita e in Yemen, o come avviene come maggiore regolarità in Egitto, lungo il corso del fiume Nilo.
Nel gennaio 2020 la Libia ha ufficialmente notificato, per la prima volta, due focolai di RVF nella parte sud orientale del paese (WAHIS, 2020; Nielsen et al., 2020). A questi due primi focolai ne sono succeduti altri sei. Complessivamente cinque focolai sono concentrati nel distretto sud orientale di Alkufrah, mentre tre sono stati rilevati nella parte centrale e sud-occidentale della Libia (Figura 1).
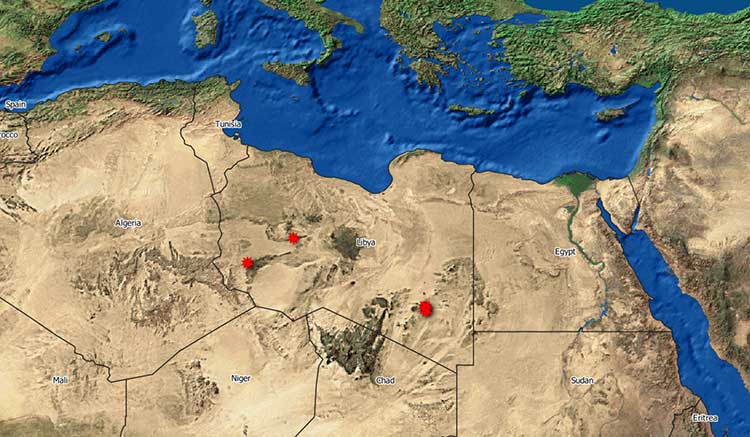
Figura 1. Distribuzione geografica dei focolai di RVF in Libia (Fonte: WAHID-OIE 2020)
La mancanza di informazioni epidemiologiche dettagliate sull’origine degli animali coinvolti in questi focolai in Libia non permette di avanzare ipotesi sull’origine dell’infezione, sebbene è da rimarcare che la data del 12 dicembre 2019 è stata registrata come probabile inizio della malattia nei primi focolai, più o meno in concomitanza con una vasta epidemia di RVF in Sudan (Nielsen et al., 2020).
La situazione di instabilità in cui versa la Libia e la crescente mancanza di sicurezza in talune regioni del Sahel e del Sahara sono tutti fattori che possono modificare le tradizionali rotte di spostamento degli animali in queste aree (Nielsen et al., 2020; EFSA, 2015). Movimentazioni incontrollate di animali tra il Sahel e i Paesi del Maghreb sono ampiamente documentate, come nel caso di dromedari positivi alla RVF provenienti dalla Mauritania, trovati positivi nel sud del Marocco Morocco (El-Harrak et al., 2011; Nielsen et al., 2020) o di ovi-caprini sierologicamente positivi trovati nei territori Sahrawi in Algeria, probabilmente provenienti dal Mali e dalla Mauritania (Di Nardo et al., 2014; Nielsen et al., 2020). Da tener conto che animali originari del Ciad e del Sudan sono stati trovati in Libia, così come pecore provenienti dal Mali sono state rintracciate nel centro della Tunisia (Bouguedour et al., 2016; Nielsen et al., 2020). Inoltre, uno studio recentemente pubblicato (Selmi et al., 2020) ha rilevato anticorpi nei confronti del virus della RVF nel 34% dei dromedari in Tunisia.
In tale contesto, la presenza dell’infezione in Libia dovrebbe suscitare attenzione da parte dell’Italia, data la vicinanza delle coste libiche al territorio italiano e considerando che i vettori infetti possono essere trasportati dai venti che spirano sopra al mare anche per lunghe distanze, sino a raggiungere le coste italiane. Inoltre, la complessa situazione sociale presente in Libia derivante dalla guerra e la contemporanea circolazione del virus SARS-CoV-2 possono rendere più complesso il tempestivo rilievo da parte delle autorità libiche della diffusione della RVF nella popolazione animale o umana.
Per tutte queste ragioni, in un recente parere scientifico, l’Autorità Europea per la Sicurezza Alimentare (EFSA) (Nielsen et al., 2020) ha formulato la seguente raccomandazione: “Considerando il possibile rischio futuro d’infezione rappresentato dalla diffusione della RVF in aree vicine ai confini dell’Unione Europea (UE), è di estrema importanza per la UE stabilire e mantenere una stretta collaborazione con i paesi del Nord Africa e del Medio Oriente per la sorveglianza sulla possibile introduzione della malattia dalle aree attualmente infette, così come monitorare con attenzione l’evoluzione delle epidemie nei paesi africani”.
Da questo punto di vista un paese chiave nel Maghreb è la Tunisia, per la sua posizione strategica nel centro dell’area e la sua vicinanza alla Libia. È fondamentale, quindi, incrementare la collaborazione con la Tunisia per sostenere e aiutare questo paese nelle attività di sorveglianza sulla possibile introduzione della RVF e, qualora necessario, nell’attivare rapide ed efficaci misure di controllo. Le conseguenze di una qualsiasi difficoltà o ritardo nell’applicazione di tali misure, infatti, sarebbero pagate non solo dalla Tunisia, ma molto probabilmente anche dai paesi più vicini, come l’Italia.
Per quanto concerne la sorveglianza nei confronti della RVF in aree indenni, come la Tunisia o l’Italia, l’obiettivo principale rimane quello di attivare un sistema di allerta rapido in grado di rilevare precocemente la presenza della malattia, qualora introdotta. A tal fine, l’uso di un sistema di animali sentinella avrebbe costi proibitivi a meno che non fosse possibile limitarne l’uso in aree ristrette con caratteristiche ecologiche tali da farle considerare maggiormente a rischio (Chevalier, 2013).
L’introduzione della RVF in una popolazione di ruminanti pienamente recettivi, come potrebbe essere quella della Tunisia o dell’Italia, causerebbe un cospicuo numero di casi clinici, con mortalità nei giovani animali e aborti massivi. Per questo motivo la sorveglianza passiva o sindromica risulta la miglior scelta in aree indenni. La sorveglianza sindromica si basa sul rilievo precoce di cluster caratterizzati da indicatori di malattia di vario tipo, piuttosto che da specifici segni clinici, e così riduce il ritardo tra la comparsa dei primi effetti della malattia e la diagnosi (Chevalier, 2013). Tale approccio può essere un utile alternative nel caso della RVF, che può provocare segni clinici non specifici, sia negli animali che nell’uomo (Chevalier, 2013).
Un rafforzamento della sorveglianza su aborti, natimortalità e mortalità neonatale, dovrebbe essere attivato durante l’estate e l’autunno nelle aree a maggior rischio di introduzione della malattia. Durante la stagione di presenza dei vettori, nel caso di rilievo di tassi di aborto o mortalità inconsueti, tutti i feti abortiti e gli animali morti dovrebbero essere analizzati anche per la presenza del virus della RVF.
I servizi veterinari, compreso il sistema diagnostico veterinario, dovrebbe essere pronto e adeguatamente addestrato per reagire immediatamente in caso di sospetto di RVF e le procedure per l’eventuale utilizzo dei vaccini già pronte per la loro esecuzione.
La RVF è già arrivata dietro l’angolo e il contesto epidemiologico in Nord Africa indica chiaramente che è tempo per l’Italia di rafforzare l’intero suo sistema di prevenzione per essere pronto nell’infausto caso di una introduzione della malattia.
Bibliografia
- Anyangu A.S., Gould L.H., Sharif S.K., Nguku P.M., Omolo J.O., Mutonga D., Rao C.Y., Lederman E.R., Schnabel D., Paweska J.T., Katz M., Hightower A., Njenga M.K., Feikin D.R. & Breiman R.F. 2010. Risk factors for severe Rift Valley fever infection in Kenya, 2007. Am J Trop Med Hyg. 83(2 Suppl):14-21
- Balkhy H.H. & Memish Z.A. 2003. Rift Valley Fever: An uninvited zoonosis in the Arabian Peninsula. Int J Antimicrob Agents. 21,153–157
- Bouguedour R. & Ripani A. 2016. Review of the foot and mouth disease situation in North Africa and the risk of introducing the disease into Europe. Rev Sci Tech. 35, 757–768
- Chevalier V., 2013. Relevance of Rift Valley fever to public health in the European Union. Clin Microbiol Infec, Volume 19 Number 8
- Di Nardo A., Rossi D., Saleh S.M.L., Lejlifa S.M., Hamdi S.J., Di Gennaro A., Savini G. & Thrusfield M.V., 2014. Evidence of Rift Valley fever seroprevalence in the Sahrawi semi-nomadic pastoralist system, Western Sahara. BMC Vet Res. 10, 92
- El-Harrak M., Martín-Folgar R., Llorente F., Fernández-Pacheco P., Brun A., Figuerola J. & Jiménez-Clavero M. 2011. Rift Valley and West Nile Virus Antibodies in Camels, North Africa. Emerg. Infect. Dis. 17, 2372–2374
- European Food Safety Authority (EFSA) 2005, AHAW Panel Members, Opinion of the Scientific Panel on Animal Health and Welfare (AHAW) on a request from the Commission related to ‘‘The risk of a Rift Valley fever incursion and its persistence within the Community’’,11 October 2005, pp. 1–130
- Ikegami T. & Makino S. 2011. The pathogenesis of Rift Valley Fever. Viruses 3, 493–519
- Nielsen SS, Alvarez J, Bicout DJ, Calistri P, Depner K, Drewe JA, Garin-Bastuji B, Rojas JLG, Schmidt CG, Michel V, Chueca MAM, Roberts HC, Sihvonen LH, Stahl K, Calvo AV, Viltrop A, Winckler C, Bett B, Cetre-Sossah C, Chevalier V, Devos C, Gubbins S, Monaco F, Sotiria-Eleni A, Broglia A, Abrahantes JC, Dhollander S, Van Der Stede Y and Zancanaro G, 2020. Rift Valley Fever – epidemiological update and risk of introduction into Europe. EFSA Journal 2020;18(3):6041, 72 pp
- Selmi R, Mamlouk A, Ben Said M, Ben Yahia H, Abdelaali H, Ben Chehida F, Daaloul-Jedidi M, Gritli A, Messadi L. First serological evidence of the Rift Valley fever Phlebovirus in Tunisian camels. Acta Trop. 2020 Jul;207:105462. doi: 10.1016/j.actatropica.2020.105462. Epub 2020 Apr 20. PMID: 32325049
- World Organisation for Animal Health (OIE) 2016. Rift Valley fever (infection with Rift Valley fever virus). OIE Terrestrial manual 2016
- World Organisation for Animal Health (OIE) 2019 Technical Card. Rift valley fever
- World Organisation for Animal Health (OIE) WAHIS, 2020
- Zeller H.G., Fontenille D., Traore-Lamizana M., Thiongane Y. & Digoutte J.P. 1997 Enzootic activity of Rift Valley Fever virus in Senegal. Am J Trop Med Hyg. 56, 265–272.
Paolo Calistri
Centro Operativo Veterinario per l'Epidemiologia, Programmazione,
Informazione e Analisi del Rischio
Istituto Zooprofilattico Sperimentale dell'Abruzzo e del Molise "G. Caporale"