Epidemiologia della malattia nodulare contagiosa dei bovini in Europa e nei Paesi limitrofi
La Lumpy Skin DIsease (LSD) o Dermatite Nodulare Contagiosa è una malattia economicamente importante del bestiame ed è trasmessa da un Poxvirus membro del genere Capripoxvirus appartenente alla famiglia Poxviridae che causa lesioni cutanee caratteristiche.
La dermatite nodulare contagiosa è una malattia con elevata morbilità e basso tasso di mortalità e colpisce i bovini di tutte le età e razze; la malattia è un'infezione specifica del bestiame e dei bufali d'acqua asiatici (Bubalus bubalis), anche se la mortalità è significativamente più bassa nei bufali (1,6%) rispetto al bestiame (30,8%) (El-Nahas E.M. et al., 2011) (Tuppurainen E. et al., 2017).
Il virus della (LSDV) provoca manifestazioni cliniche molto caratteristiche e facilmente riconoscibili. Dopo un primo periodo di febbre e linfoadenopatia l'animale sviluppa noduli cutanei grandi e duri, larghi fino a 5 cm di diametro. Questi possono localizzarsi su tutto il corpo, ma in particolare su aree dove la peluria è scarsa come testa, mammella, scroto e perineo (Beard P.M., 2016).
In generale, il contatto diretto si è dimostrato un percorso inefficace per la trasmissione del virus, ma le prove sperimentali in merito sono scarse. Ad oggi, solo la trasmissione meccanica è stata scientificamente dimostrata.
Negli animali gravemente infetti le lesioni nodulari contengono alte quantità di virus, costituendo una fonte abbondante di contaminazione per gli artropodi morsicatori che vi compiono il pasto di sangue.
Le lesioni cutanee aperte e le ulcere sono infatti una fonte attraente di nutrienti per le mosche ed il virus è noto sopravvivere nelle lesioni cutanee per almeno 39 giorni dopo l'infezione.
La mosca cavallina (Stomoxys calcitrans), con una distribuzione globale, è la specie vettoriale più implicata per la diffusione di LSDV. Queste mosche sono morsicatori aggressivi e persistenti e, poiché la loro puntura è dolorosa il pasto è spesso interrotto dall'ospite infastidito, comportando uno spostamento della stessa mosca su un altro ospite; in questo modo la mosca ha bisogno mediamente di tre o cinque tentativi di alimentazione per raggiungere la sazietà.
La trasmissione meccanica del virus della LSD è stata dimostrata sperimentalmente da ospite infetto a ospite in esemplari maschi di zecche appartenenti alle specie Rhipicephalus appendiculatus (Tuppurainen et al., 2013) e Amblyomma hebraeum (Lubinga et al., 2013). Il virus è stato dimostrato nella saliva delle zecche dopo il pasto su bovini infetti (Lubinga et al., 2013); in oltre è stata segnalata anche la trasmissione transtadiale del virus (Lubinga et al., 2014b).
Epidemiologia
La malattia è stata segnalata per la prima volta in Zambia nel 1929. Fino al 1984, l'LSD è stata mantenuta all'interno dei paesi dell'Africa subsahariana, dove la sua patogenicità è aumentata nel tempo portando a gravi pandemie. Dal 1984 la malattia ha fatto diversi salti transcontinentali. Il primo salto transcontinentale è avvenuto nel 1989, quando la malattia si è diffusa dai paesi africani al Medio Oriente asiatico, in Israele, probabilmente grazie al vento che ha trasportato mosche cavalline (Stomoxys calcitrans) infette dall'Egitto. Nonostante le campagne di vaccinazione del bestiame messe in atto, sia in Egitto che in Israele, con il poxvirus ovino per controllare l'infezione, i casi di LSD sono riemersi in Egitto e Israele nel 2006 (Tuppurainen et al., 2017; Alkhamis et al., 2016; Awad W.S. et al., 2010). Dopo questi focolai e il conflitto siriano, il virus si è potuto diffondere nei paesi del Medio Oriente e in Turchia.
Dal 2015 al 2016, la malattia si è spostata dalla parte occidentale della Turchia attraverso otto paesi balcanici (Albania, Montenegro, Serbia, Grecia, Bulgaria e Macedonia) e dalla parte opposta fino a raggiungere la Federazione Russa. A partire dal 2017 i focolai Balcanici sono diminuiti fino a scomparire nel 2018 a grazie alla vaccinazione con ceppo omologo del virus dell’ LSD contestualmente alle misure di controllo messe in atto nella regione. Nel 2018 i focolai sono stati segnalati solo in Russia (63), Turchia (46) e Georgia (6). (EFSA Journal 2019, Scientific report on lumpy skin disease: III).
L'ultima e terza relazione dell'EFSA sull'LSD, pubblicata il 29 febbraio 2019, fornisce una descrizione della situazione epidemiologica della malattia (Figura. 1) e della campagna di vaccinazione in atto in Europa (Figure 2 e 3) e nei paesi limitrofi, come la Turchia e la Federazione russa, fino alla fine del 2018.
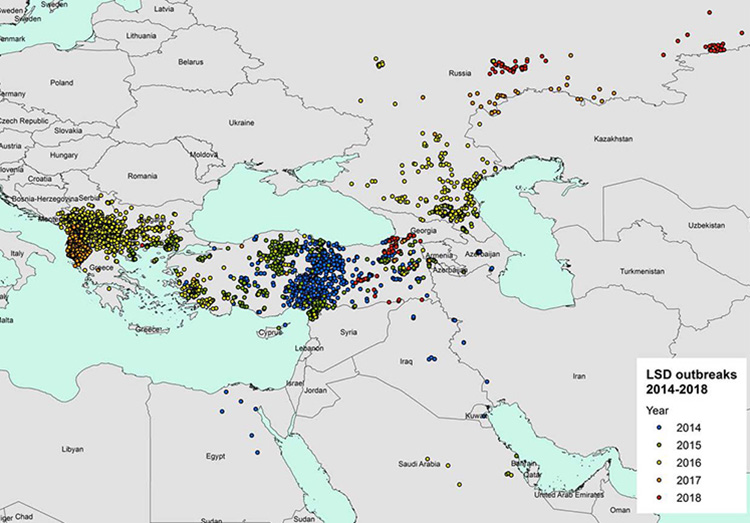
Figura 1. Focolai di LSD notificati in Europa e Medio Oriente tra il 2014 e il 2018 (fonte dei dati: autorità nazionali e ADNS per quei paesi che notificano all'ADNS (Animal Disease Notification System) e Empres-I per gli altri paesi) (EFSA, Scientific report on lumpy skin disease: III. Raccolta e analisi dei dati)
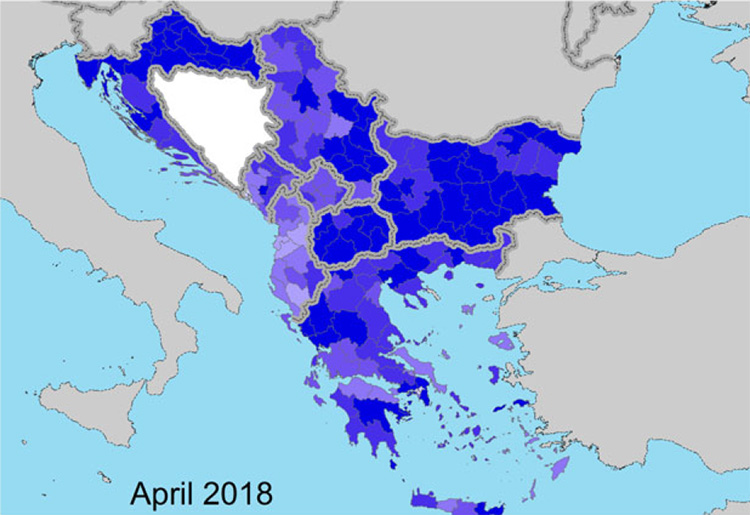
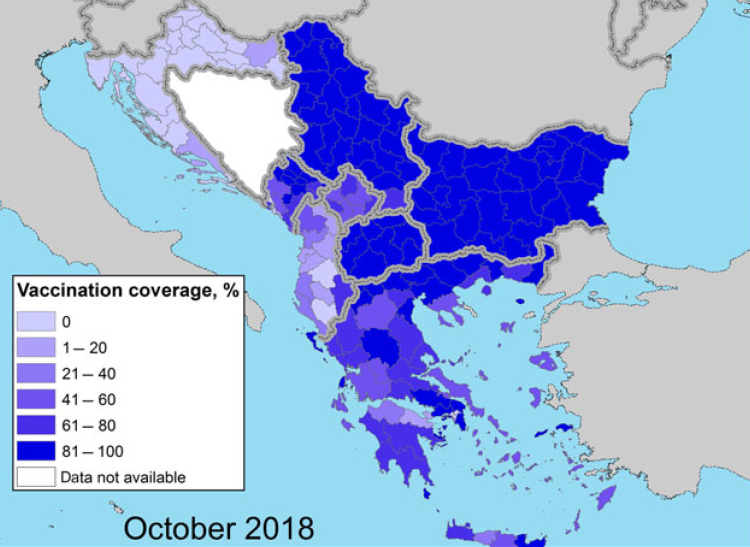 Figure 2 e 3. Copertura vaccinale ottenuta nell’anno 2018 ( proporzione degli animali immunizzati sul totale degli animali presenti) nella regione balcanica durante la stagione vettoriale, all’inizio di Aprile e alla fine di Ottobre. (EFSA, Scientific report on lumpy skin disease: III. Data collection and analysis)
Figure 2 e 3. Copertura vaccinale ottenuta nell’anno 2018 ( proporzione degli animali immunizzati sul totale degli animali presenti) nella regione balcanica durante la stagione vettoriale, all’inizio di Aprile e alla fine di Ottobre. (EFSA, Scientific report on lumpy skin disease: III. Data collection and analysis)
Da come si può leggere nel rapporto "Nel 2018 non sono stati segnalati focolai di LSD nella regione balcanica dopo un calo del numero di focolai segnalati nel 2017 (385) rispetto al 2016 (7.483). Ciò conferma l'efficacia della campagna di vaccinazione basata sul ceppo omologo del virus dell’LSD e sulle misure di controllo coordinate messe in atto nella regione. L'interruzione dell'epidemia di LSD raggiunta nei Balcani nel 2018 è coerente con l'obiettivo a lungo termine della strategia di vaccinazione messa in atto in Europa sudorientale con il fine di ripristinare la situazione dello status “LSD free”.
Nel 2018, i focolai di LSD sono stati segnalati solo in Russia (63 focolai), Turchia (46 focolai) e Georgia (6 focolai) nel periodo tra aprile e novembre, confermando così il modello stagionale dell’LSD. Rispetto al 2017, l’epidemia nella Federazione Russa si è espansa verso nord e verso est lungo il confine con il Kazakistan, mentre in Turchia la maggior parte dei focolai sono stati segnalati nelle regioni orientali. I focolai in Turchia rappresentano una minaccia per i paesi vicini dell'UE, in particolare per Grecia e Bulgaria, che possono essere a rischio di nuove incursioni".
In un recente ed interessante studio pubblicato nel 2019 sulle variabili climatiche, la copertura del suolo e la densità del bestiame sono state dimostrate tramite modelli matematici essere positivamente associate alla distribuzione spaziale dei focolai di LSD in una vasta area. Fluttuazioni di temperatura annuale più elevati sono associati ad un rischio più alto di focolai di LSD cosi come i terreni coltivati hanno 2,1 (95% CR: 1,2–2,5) volte le probabilità di ospitare focolai di LSD rispetto alle aree boschive. Ciò è probabilmente dovuto alle condizioni di sopravvivenza dei vettori ma ci potrebbero essere altre spiegazioni come la vicinanza con l'area urbana che facilita la sorveglianza. Tuttavia, rimane sempre la possibilità di lunghi salti dovuti alle movimentazioni di bovini infetti, il che significa che anche paesi lontani dai foci epidemici attivi rimangono a rischio. (Allepuz A., Casal J. e Beltran-Alcrudo D., 2019).
Campagna di vaccinazione
L'EFSA ha studiato gli effetti della vaccinazione applicata secondo strategie diverse (nessuna vaccinazione, vaccinazione iniziata dopo l'incursione della malattia e vaccinazione completata prima dell'incursione della malattia) combinata con l’abbattimento parziale rispetto allo stamping out totale della mandria infetta. La vaccinazione preventiva è risultata essere la strategia più efficace per sradicare la malattia e l’abbattimento parziale (cioè dei soli animali infetti) rispetto allo stamping out (dopo il rilevamento di un caso infetto) hanno dimostrato avere la stessa efficacia.
Nei paesi colpiti sono stati utilizzati due tipi di vaccini: l'eterologo derivato dal poxvirus ovino e caprino e il ceppo omologo attenuato. A partire dal 2016 sono state condotte campagne di vaccinazione di massa con vaccini omologhi vivi contro l'LSDV in tutti i paesi colpiti dell’Europa sudorientale ed in Croazia. Gli alti livelli di efficacia (oltre il 70 %) hanno dimostrato l'effetto protettivo della vaccinazione in questi paesi. Nel 2018 non sono stati segnalati focolai nei paesi in cui la campagna di vaccinazione ha avuto luogo a partire dal 2016, dopo l'ingresso della malattia, con ceppo omologo attenuato dal virus vivo come in Croazia e Bosnia Erzegovina dove si è svolta una vaccinazione preventiva. Nel 2018 sono invece emersi nuovi focolai in Russia, Turchia e Georgia che hanno dimostrato la tendenza a spostarsi verso est e verso nord. In questi paesi è stato utilizzato un ceppo eterologo (vaccino contro il virus del vaiolo delle pecore e delle capre), per lo più come vaccinazione reattiva (cioè la vaccinazione attuata dopo l'ingresso della malattia in una regione) nelle aree colpite, ottenendo una copertura di circa il 70%. In Georgia, che ha sperimentato la malattia dal 2016, la vaccinazione è stata messa in atto come misura preventiva dal 2014, dopo che sono stati rilevati focolai di LSD nel vicino Azerbaigian, creando così una zona cuscinetto di almeno 10 km lungo i confini con il paese di cui sopra. Gli studi hanno dimostrato che i vaccini attenuati di Neethling utilizzati con successo nei Balcani sono più efficaci dei vaccini contro il vaiolo della pecora attenuato utilizzati in Turchia, Federazione Russa e Georgia (Ben-Gera et al., 2015).
Il declino transitorio della produzione di latte, il nodulo nel sito di iniezione, la perdita di appetito e il gonfiore sono i sintomi riportati sul campo dopo la vaccinazione. Ancora una volta, l'esperienza sul campo indica che gli animali di solito non mostrano alcuna reazione avversa dopo la seconda iniezione. In Croazia e Bosnia Erzegovina, dove sono state effettuate vaccinazioni preventive su larga scala nel 2016 e nel 2017, è stato possibile ottenere ulteriori informazioni sugli effetti collaterali senza interferenze da parte del ceppo di campo.
I primi dati riportati dai servizi veterinari croati attraverso il sistema farmaceutico hanno mostrato reazioni avverse post-vaccinazione nello 0,19% degli allevamenti vaccinati e nello 0,09% degli animali con valori di decessi allo 0,02% (EFSA, 2017).
La maggior parte dei sintomi sono stati segnalati entro due settimane dalla vaccinazione e comprendevano febbre, diminuzione della produzione di latte ed edema nel sito di iniezione (EFSA 2018). Tuttavia, queste relazioni si basano su una serie di casi senza controlli adeguati risultando così impossibile stimare correttamente le perdite di produzione (produzione di latte, mortalità, morbilità, ecc.).
La vaccinazione e la macellazione selettiva degli animali infetti si sono dimostrate misure efficaci per controllare la malattia. In particolare, dovrebbero essere incoraggiate la vaccinazione preventiva e l'uso del vaccino omologo. Il movimento degli animali infetti al di fuori dei controlli ufficiali rimane l'aspetto più difficile della gestione della malattia e dovrebbe sempre essere preso in considerazione quando nuovi focolai appaiono lontani dai focolai esistenti.
Bibliografia
- Alkhamis M.A. and VanderWaal K. (2016). Spatial and Temporal Epidemiology of Lumpy Skin Disease in the Middle East, 2012–2015. Front. Vet. Sci. 3:19. doi: 10.3389/fvets.2016.00019
- Allepuz A, Casal J, Beltrán-Alcrudo D. Spatial analysis of lumpy skin disease in Eurasia— Predicting areas at risk for further spread within the region. Transbound Emerg Dis. 2019; 66:813–822
- Awad W.S., Ibrahim A.K., Mahran K., Fararh K.M., Moniem MIA (2010). Evaluation of different diagnostic methods for diagnosis of lumpy skin disease in cows. Trop Anim Health Prod 42(4): 777-783
- Beard P.M. 2016. Lumpy skin disease: a direct threat to Europe. Veterinary Record May 28, 2016. doi: 10.1136/vr.i2800
- Ben-Gera, J., Klement, E., Khinich, E., Stram, Y., & Shpigel, N. Y. (2015). Comparison of the efficacy of Neethling lumpy skin disease virus and x10RM65 sheep‐pox live attenuated vaccines for the prevention of lumpy skin disease – The results of a randomized controlled field study. Vaccine, 38, 4837–4842
- EFSA (European Food Safety Authority), Calistri P, DeClercq K, Gubbins S, Klement E, Stegeman A, Corti~nas Abrahantes J, Antoniou S-E, Broglia A and Gogin A, 2019. Scientific report on lumpy skin disease: III. Data collection and analysis. EFSA Journal 2019;17(3):5638, 26 pp.
- El-Nahas E.M., El-Habbaa A.S., El-Bagoury G.F. and Radwan M.E.I. 2011. Isolation and identification of lumpy skin disease virus from naturally infected buffaloes at Kaluobia, Egypt. Global Veterinaria, 7: 234-237
- Lebedev, N. (2016). Standing Group of Experts on Lumpy Skin Disease in Europe under the GF-TADs Umbrella.
- Lubinga, J.C., Tuppurainen, E.S.M., Stoltsz, W.H., Ebersohn, K., Coetzer, J.A.W., Venter, E.H., 2013. Detection of lumpy skin disease virus in saliva of ticks fed on lumpy skin disease virus-infected cattle. Exp. Appl. Acarol. 61, 129–138
- Lubinga, J.C., Tuppurainen, E.S.M., Coetzer, J.A.W., Stoltsz, W.H., Venter, E.H., 2014. Evidence of lumpy skin disease virus over-wintering by transstadial persistence in Amblyomma hebraeum and transovarial persistence in Rhipicephalus decoloratus ticks. Exp. Appl. Acarol. 62, 77–90
- Sprygina A.,Pestovaa Y. , Wallaceb D.B., Tuppurainena E., Kononova A.V. Transmission of lumpy skin disease virus: A short review
- Tuppurainen, E.S., Lubinga, J.C., Stoltsz, W.H., Troskie, M., Carpenter, S.T., Coetzer, J.A., Venter, E.H., Oura, C.A., 2013. Mechanical transmission of lumpy skin disease virus by Rhipicephalus appendiculatus male ticks. Epidemiol. Infect. 141, 425–430
- Tuppurainen E., Alexandrov T. & Beltrán-Alcrudo D. 2017. Lumpy skin disease field manual – A manual for veterinarians. FAO Animal production and Health Maual No. 20. Rome. Food and Agriculture Organization of the United Nations (FAO). 60 pages.
Valentina Zenobio
Centro Operativo Veterinario per l'Epidemiologia, Programmazione,
Informazione e Analisi del Rischio
Istituto Zooprofilattico Sperimentale dell'Abruzzo e del Molise "G. Caporale"